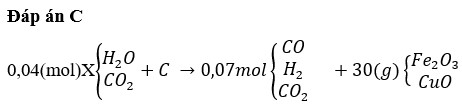hỗn hợp x gồm fe3o4 và fe2o3 được chia làm hai phần bằng nhau cho hỗn hợp khí Y gồm H2 và CO (lấy dư) đi qua 1 phần (nung nóng), toàn bộ sản phẩm sau phản ứng được dẫn qua bình 1 đựng axit sunfuric đặc, dư bình 2 đựng nước vôi trong (lấy dư). sau TN, khối lượng bình 1 tặng 5,4g, bình 2 có 40g kết tủa
phần 2 cho vào dd hcl dư, thêm tiếp dd naoh dư vào, lọc, lấy kết tủa rửa sạch, nung trong kk đến khối lượng ko đổi thu dc 40g CR
tính % khối lượng các oxit trong hỗn hợp x(cho các phản ứng xảy ra HOÀN TOÀN)
giúp e vss
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Phần 1:
\(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
______0,2<-------------0,2
CO2 + Ca(OH)2 --> CaCO3 + H2O
0,2<------------------0,2
=> nCO = 0,2 (mol)
Phần 2:
\(n_{Cu}=\dfrac{19,2}{64}=0,3\left(mol\right)\)
PTHH:CuO + CO --to--> Cu + CO2
__________0,2------->0,2
CuO + H2 --to--> Cu + H2O
_____0,1<-------0,1
=> Trong mỗi phần, nCO = 0,2(mol); nH2 = 0,1 (mol)
=> Trong hh ban đầu, nCO = 0,4(mol);nH2 = 0,2 (mol)
=> \(\left\{{}\begin{matrix}V_{CO}=0,4.22,4=8,96\left(l\right)\\V_{H_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
=> Vhh = 8,96 + 4,48 = 13,44 (l)
b)
\(\left\{{}\begin{matrix}\%m_{CO}=\dfrac{0,4.28}{0,4.28+0,2.2}.100\%=96,55\%\\\%m_{H_2}=\dfrac{0,2.2}{0,4.28+0,2.2}.100\%=3,45\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{8,96}{13,44}.100\%=66,67\%\\\%V_{H_2}=\dfrac{4,48}{13,44}.100\%=33,33\%\end{matrix}\right.\)

Em tham khảo nhé !! Không hiểu cứ thắc mắc :)))
2CO + O2 -> 2CO2
2H2 + O2 -> 2H2O
Dẫn sản phẩm qua nước vôi trong
CO2 + Ca(OH)2 -> CaCO3 + H2O
-> mCaCO3=20 gam -> nCaCO3=nCO2=0,2 mol=nCO
PHần 2:
CuO + CO -> Cu + CO2
CuO + H2 -> Cu + H2O
Ta có: nCu=19,2/64=0,3 mol=nCO +nH2
Mà nCO=0,2 mol -> nH2=0,1 mol
-> hỗn hợp ban đầu chứa 0,4 mol CO và 0,2 mol H2
-> n hỗn hợp=0,4+0,2=0,6 mol -> V hỗn hợp=0,6.22,4=13,44 lít
Ta có: % thể tích= % số mol
->% V CO=0,4/0,6=66,67% ->% V H2=33,33%
m hỗn hợp=0,4.28+0,2.2=11,6 gam
-> % mCO=0,4.28/11,6=96,55% ->%mH2=3,45%
Tại sao n hỗn hợp ban đầu lại chứa 0,4mol CO và 0,2mol H2 vậy ah ?

Chọn C
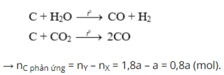
Theo bài ra có khối lượng chất rắn giảm chính bằng khối lượng O bị lấy ra khỏi oxit.
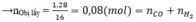
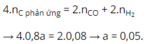
Bảo toàn electron:

Phần 1:
2CO + O2 -to> 2CO2
2H2 + O2 -to> 2H2O
Dẫn sản phẩm qua nước vôi trong
CO2 + Ca(OH)2 -> CaCO3 + H2O
-> mCaCO3=20 gam -> nCaCO3=nCO2=0,2 mol=nCO
PHần 2:
CuO + CO -to> Cu + CO2
CuO + H2 -to> Cu + H2O
Ta có: nCu=19,2/64=0,3 mol=nCO +nH2
Mà nCO=0,2 mol -> nH2=0,1 mol
-> hỗn hợp ban đầu chứa 0,4 mol CO và 0,2 mol H2
-> n hỗn hợp=0,4+0,2=0,6 mol -> V hỗn hợp=0,6.22,4=13,44 lít
Ta có: % thể tích= % số mol
->% V CO=\(\dfrac{0,4}{0,6}\)=66,67% ->% V H2=33,33%
m hỗn hợp=0,4.28+0,2.2=11,6 gam
-> % mCO=\(\dfrac{0,4.28}{11,6}\)=96,55% ->%mH2=3,45%

Đáp án D:
![]()
Bảo toàn electron cho quá trình khử Oxit của COta có(l)
ne cho = ne nhận ne nhận
Bảo toàn e cho quá trình Oxi hóa bởi H2SO4 (2)
=> ne cho = ne nhận ne cho
Vì các Oxit trước quá trình 1 và sau quá trình 2 ở trạng thái có số oxi hóa cao nhất
=> ne nhận = ne cho
Vì các Oxit trước quá trình 1 và sau quá trình 2 ở trạng thái có số oxi hóa cao nhất
=> ne nhận = ne cho
![]()

\(n_{Fe}=a,n_{Fe_2O_3}=b:trong.1.phần\\ Phần.I:\\ Fe_2O_3+3H_2->2Fe+3H_2O\\ n_{Fe}=a+2b=\dfrac{11,2}{56}=0,2\left(I\right)\\ Phần.II:\\ Fe+2HCl->FeCl2+H_2\\ a=\dfrac{2,24}{22,4}=0,1\\ b=0,05\\ \%m_{Fe}=\dfrac{56\cdot0,1}{56\cdot0,1+0,05\cdot160}=41,18\%\\ \Rightarrow\%m_{Fe_2O_3}=58,82\%\)

Đáp án B
CuO và Fe2O3 bị khử, MgO không bị khử bởi CO.
Chất rắn sau phản ứng là MgO, Cu, Fe.