Phản ứng của sodium chloride rắn, hay của sodium iodide rắn với sulfuric acid đặc là phản ứng oxi hóa – khử? Vì sao?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Phương trình hoá học của phản ứng:
NaCl + H2SO4 (đặc) → NaHSO4 + HCl (1)
2NaBr + 3H2SO4 → 2NaHSO4 + Br2 + SO2 + 2H2O (2)
b) Phản ứng (1) không có sự thay đổi số oxi hoá của các nguyên tố, H2SO4 đặc đóng vai trò là acid.
Phản ứng (2) số oxi hoá của sulfur giảm từ +6 xuống +4, sulfuric acid đóng vai trò là chất oxi hoá.

a) 2Na + H2SO4 --> Na2SO4 + H2
b) \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + H2SO4 --> Na2SO4 + H2
_____0,2------>0,1-------------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
c) mH2SO4 = 0,1.98 = 9,8(g)

- 4 dung dịch cần nhận biết là: NaCl, NaBr, NaI, HCl
- Hóa chất: Giấy quỳ tím, dung dịch silver nitrate
- Dụng cụ: 4 ống nghiệm
- Tiến hành thí nghiệm và kết quả:
Bước 1: Lấy ở mỗi bình khoảng 2 mL dung dịch vào 4 ống nghiệm tương ứng
Bước 2: Sử dụng quỳ tím nhúng vào 4 dung dịch trong 4 ống nghiệm. Ống nghiệm nào làm quỳ tím hóa đỏ => Dung dịch hydrochlodric acid
Bước 3: Nhỏ khoảng 2 mL dung dịch silver nitrate vào 3 ống nghiệm còn lại và có những hiện tượng sau:
Ống nghiệm xuất hiện kết tủa trắng AgCl => Ống nghiệm đó chứa NaCl
NaCl + AgNO3 → AgCl↓ + NaNO3
Ống nghiệm xuất hiện kết tủa vàng nhạt AgBr => Ống nghiệm đó chứa NaBr
NaBr + AgNO3 → AgBr↓ + NaNO3
Ống nghiệm xuất hiện kết tủa vàng AgI => Ống nghiệm đó chứa NaI
NaI + AgNO3 → AgI↓ + NaNO3

Trong thí nghiệm điều chế ethyl acetate, không đun sôi hỗn hợp phản ứng vì nhiệt độ sôi của ethyl acetate thấp (77,1 oC), ethyl acetate sẽ bị bay hơi khi đun sôi hỗn hợp phản ứng.
Dung dịch sodium chloride bão hoà nặng hơn ethyl acetate, ethyl acetate nổi lên trên, do đó việc tách ester ra khỏi hỗn hợp sau phản ứng dễ hơn.

Câu 1 :
\(n_{Na2CO3}=\dfrac{10,6}{106}=0,1\left(mol\right)\)
Pt : \(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O|\)
1 1 1 1 1
0,1 0,1 0,1 0,1
a) \(n_{H2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{ddH2SO4}=\dfrac{0,1}{1}=0,1\left(l\right)\)
b) \(n_{CO2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{CO2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
c) \(n_{Na2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(C_{M_{Na2SO4}}=\dfrac{0,1}{0,1}=1\left(M\right)\)
Chúc bạn học tốt

Bài 8: Bạn bổ sung thêm đề phần này nhé.
Bài 9: Bài này giống bài 2 bên dưới nhé.
Bài 10:
\(n_{Fe\left(NO_3\right)_3}=0,3.1=0,3\left(mol\right)\)
PT: \(Fe\left(NO_3\right)_3+3NaOH\rightarrow3NaNO_3+Fe\left(OH\right)_3\)
a, \(n_{NaOH}=3n_{Fe\left(NO_3\right)_3}=0,9\left(mol\right)\Rightarrow V_{NaOH}=\dfrac{0,9}{2}=0,45\left(l\right)\)
b, \(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_2}=\dfrac{1}{2}n_{Fe\left(NO_3\right)_3}=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,15.160=24\left(g\right)\)
Bài 11:
Ta có: \(n_{NaOH}=\dfrac{200.12\%}{40}=0,6\left(mol\right)\)
PT: \(2NaOH+FeCl_2\rightarrow2NaCl+Fe\left(OH\right)_2\)
a, \(n_{FeCl_2}=n_{Fe\left(OH\right)_2}=\dfrac{1}{2}n_{NaOH}=0,3\left(mol\right)\Rightarrow C\%_{FeCl_2}=\dfrac{0,3.127}{100}.100\%=38,1\%\)
b, \(n_{NaCl}=n_{NaOH}=0,6\left(mol\right)\)
Ta có: m dd sau pư = 200 + 100 - 0,3.90 = 273 (g)
\(\Rightarrow C\%_{NaCl}=\dfrac{0,6.58,5}{273}.100\%\approx12,86\%\)

Cl2+NaOH->NaCl+NaClO3+H2O
\(Cl^0\rightarrow Cl^{+5}+5e\)(x1)
\(Cl^0+1e\rightarrow Cl^{-1}\)(x5)
=>Cl vừa là chất oxi hóa, vừa là chất khử
=>PT: \(3Cl_2+6NaOH\rightarrow5NaCl+NaClO_3+3H_2O\)

- Hiện tượng: Xuất hiện kết tủa trắng.
→ KL: muối tác dụng với muối tạo 2 muối mới.
PT: \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_{4\downarrow}\)
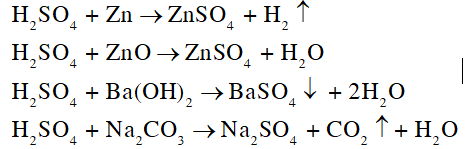
- Xét phản ứng của NaCl với H2SO4:
NaCl(s) + H2SO4(l) \(\xrightarrow{{{t^o}}}\) NaHSO4(s) + HCl(g)
=> Ion Cl- không thể hiện tính khử, không có sự thay đổi số oxi hóa
=> Không phải phản ứng oxi hóa – khử
- Xét phản ứng của NaI với H2SO4:
8NaI(s) + 9H2SO4(l) → 8NaHSO4(s) + I2(g) + H2S(g) + 4H2O(g)
=> Ion I- thể hiện tính khử và khử sulfur trong H2SO4 từ số oxi hóa +6 về số oxi hóa -2 trong H2S
- Giải thích: Do ion Cl- có tính khử yếu hơn ion I-