Để xác định nồng độ của dung dịch NaOH ta thực hiện phương pháp chuẩn độ như sau:
- Dùng pipete lấy 10ml dung dịch HCl 0,1M (dung dịch chuẩn) cho vào bình tam giác 100ml, thêm 1 - 2 giọt phnolphthalein
- Cho dung dịch NaOH cần xác định nồng độ vào burete, điều chỉnh dung dịch trong burete về mức 0
- Mở khóa burete, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) đến khi dung dịch trong bình tam giác từ không màu chuyển sang màu hồng nhạt (bền trong khoảng 10 giây) thì ngừng chuẩn độ.
- Ghi lại thể tích dung dịch NaOH đã dùng là 10,2 ml
Vậy nồng độ của dung dịch NaOH là bao nhiêu ?

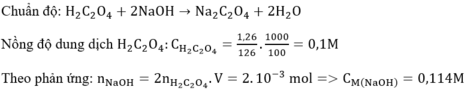

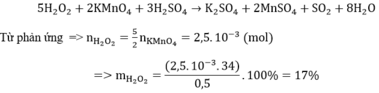
\(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có : \(n_{NaOH}=n_{HCl}\Leftrightarrow C_{MNaOH}.V_{NaOH}=C_{MHCl}.V_{HCl}\)
\(\Rightarrow C_{MNaOH}=\dfrac{C_{MHCl}.V_{HCl}}{V_{NaOH}}=\dfrac{0,1.0,01}{0,0102}\simeq0,1l=100ml\)
Sửa lại giúp tớ chỗ đơn vị Cm là mol/l