1 dung dịch có nồng độ ion OH- = 0,001 m cho biết dung dịch trên là acid base hay trung tính, màu của quỳ tím trong dung dịch
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.

[H+] = 0,010M = 10-2M ⇒ pH = -log[H+] = -log(1,0.10-2) = 2
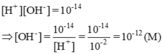
Môi trường của dung dịch này là axit (pH < 7)
Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ

[OH-]=1.10^-14/0.01=10^-12 (M) tính Ph=log[H+] từ kết quả của Ph xem nó lớn hơn 7 hay j xong suy ra môi trường ,môi trường axit thì quỳ đỏ môi trường kiềm quy xanh trung tính ko màu

\(a)n_{NaOH}=0,5.0,2=0,1mol\\ n_{H_2SO_4}=0,3.1=0,3mol\\2 NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ \Rightarrow\dfrac{0,1}{2}< \dfrac{0,3}{1}\Rightarrow H_2SO_4.dư\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,1 0,05 0,05 0,1
\(C_M\) \(_{Na_2SO_4}=\dfrac{0,05}{0,2+0,3}=0,1M\)
\(C_M\) \(_{H_2SO_4}=\dfrac{0,3-0,05}{0,2+0,3}=0,5M\)
b) Vì H2SO4 dư nên quỳ tím hoá đỏ.

\(n_{NaOH}=\dfrac{50\cdot20\%}{40}=0.25\left(mol\right)\)
\(n_{HNO_3}=\dfrac{84\cdot15\%}{63}=0.2\left(mol\right)\)
\(NaOH+HNO_3\rightarrow NaNO_3+H_2O\)
Lập tỉ lệ :
\(\dfrac{0.25}{1}>\dfrac{0.2}{1}\Rightarrow NaOHdư\)
Vì : NaOH dư nên quỳ tím sẽ hóa xanh.
\(m_{dd}=50+84=134\left(g\right)\)
\(n_{NaNO_3}=0.2\left(mol\right)\)
\(n_{NaOH\left(dư\right)}=0.25-0.2=0.05\left(mol\right)\)
\(C\%_{NaNO_3}=\dfrac{0.2\cdot85}{134}\cdot100\%=12.68\%\)
\(C\%_{NaOH\left(dư\right)}=\dfrac{0.05\cdot40}{134}\cdot100\%=1.49\%\)

pH=9 => CH+=10-9 và COH-=10-5
Đọo pH của dung dịch có môi trường kiêm nên Phenolphtalein có màu hồng (cái này trong sách giáo khoa 11 có)
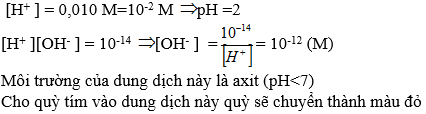

\(\left[OH^-\right]=0,001M\\ \Rightarrow pH=14-pOH=14+log\left[OH^-\right]=14+log\left[0,001\right]=14-3=11\)
thế còn màu của quỳ tím trong dung dịch ạ?