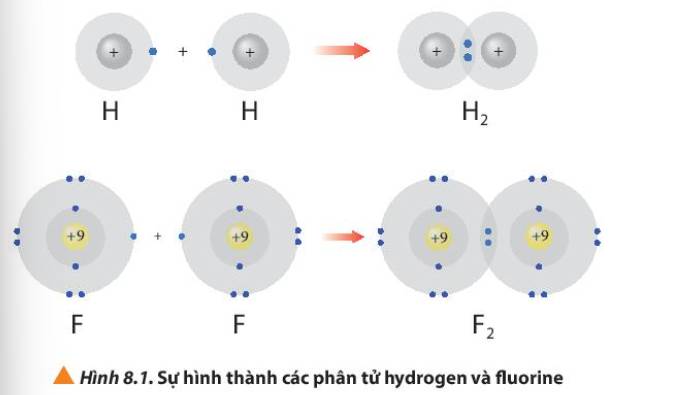
Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon

- Nguyên tử Fluorine có 7 electron ở lớp ngoài cùng => Nhận 1 electron từ nguyên tử Calcium để đạt cấu hình electron của khí hiếm
- Nguyên tử Calcium có 2 electron ở lớp ngoài cùng => Nhường 2 electron cho 2 nguyên tử Fluorine để đạt cấu hình electron của khí hiếm

Cấu hình electron của Al, Mg, Na, Ne :
Al 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 |
Mg 1 s 2 2 s 2 2 p 6 3 s 2 |
Na 1 s 2 2 s 2 2 p 6 3 s 1 |
Ne 1 s 2 2 s 2 2 p 6 |
Từ các cấu hình trên ta dễ dàng thấy rằng nếu :
nguyên tử Na nhường le để trở thành ion Na + ;
nguyên tử Mg nhường 2e để trở thành ion Mg 2 + ;
nguyên tử Al nhường 3e để trở thành ion Al 3 + ,
thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Ta đã biết cấu hình electron của các khí hiếm với 8 electron (đối với He là electron) ở lớp ngoài cùng là một cấu hình electron vững bền. Vì vậy, các nguyên tử kim loại có khuynh hướng dễ nhường electron để có cấu hình electron vững bền của khí hiếm đứng trước.

- Cấu hình electron của F (Z = 9): 1s22s22p5
- Đề xuất của bạn học sinh không hợp lí trong thực tế vì:
+ Fluorine là nguyên tử có độ âm điện lớn nên khả năng nhận 1 electron dễ hơn nhường 7 electron.
+ Hai nlguyên tử F có độ âm điện bằng nhau nên không hình thành được liên kết ion như công thức (F7+)(F-)7 mà chỉ tạo được liên kết cộng hóa trị không cực.
- Sự hình thành liên kết trong phân tử F2:
Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử F đều cần thêm 1 electron. Vì vậy mỗi nguyên tử N cùng góp 1 electron để tạo nên 1 cặp electron chung cho 2 nguyên tử N.

⟹ Hai nguyên tử F liên kết với nhau bằng liên kết cộng hóa trị không cực tạo phân tử F2:
F - F

O: 1 s 2 2 s 2 2 p 4
F: 1 s 2 2 s 2 2 p 5
Ne: 1 s 2 2 s 2 2 p 6
Từ các cấu hình trên ta dễ dàng thấy rằng nếu nguyên tử F nhận thêm 1e để trở thành ion F - , nguyên tử O nhận thêm 2e để trở thành ion O 2 - thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Như ta đã biết, cấu hình electron của các khí hiếm với 8 electron (đối với He là 2 electron) ở lớp ngoài cùng là một cấu hình electron vững bền (năng lượng thấp). Vì vậy, các nguyên tử phi kim có khuynh hướng nhận electron để có cấu hình electron vững bền của khí hiếm đứng sau.

\(a.\\ Z=11\\ 1s^22s^22p^63s^1\)
Là nguyên tố kim loại do số e của lớp ngoài cùng bằng 1
\(b.\\ Z=29\\ 1s^22s^22p^63s^23p^63d^{10}4s^1\)
Là nguyên tố kim loại do số e của lớp ngoài cùng bằng 1

Nguyên tử khí hiếm He có cấu hình electron giống Li+
Nguyên tử khí hiếm Ne có cấu hình electron giống O2-