Hoà tan 5,85g NaCl vào nước được 200ml dung dịch. Tính nộng độ mol của dung dịch thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(m_{NaOH}=0,2.40=8\left(g\right)\)
b, \(n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
\(c,C\%=\dfrac{6}{200}.100\%=3\%\)
\(m_{NaCl}=\dfrac{200.8}{100}=16\left(g\right)\)

\(n_{Na2O}=\dfrac{9,2}{62}=0,15\left(mol\right)\)
Pt : \(Na_2O+H_2O\rightarrow2NaOH|\)
1 1 2
0,15 0,3
\(n_{NaOH}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
200ml = 0,2l
\(C_{M_{NaOH}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\)
Chúc bạn học tốt

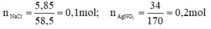
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 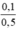 = 0,2 mol/l.
= 0,2 mol/l.

Đáp án D
nNaCl =0,1 mol, nAgNO3 = 0,2 mol
NaCl + AgNO3 → AgCl + NaNO3
0,1 → 0,1 0,1 (mol)
Vdd = 300 + 200 = 500 ml
![]() (dư) = 0,2 - 0,1 =0, 1 (mol)
(dư) = 0,2 - 0,1 =0, 1 (mol)
![]() = 0,1 mol
= 0,1 mol
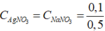 = 0,2 M
= 0,2 M

Bài tập vận dụng
VD1: Hoà tan hoàn toàn 7,45 gam KCI vào 200ml H2O thu đưoc dung dịch A. Tính nồng độ %, nồng độ mol/l
của dung dịch A.
VD2: Hoà tan hoàn toàn 0,2 mol NaOH vào 500ml H20 thu được dung dịch B. Tính nồng độ %, nồng độ mol/l
của dung dịch B.
VD3: Hoà tan hoàn toàn 2,8 gam KOH và 5,85 gam NaCl vào 600 ml H2O thu được dung dịch C. Tinh nồng độ
%, nồng độ mol/l của dung dịch C.
VD4: Hoà tan hoàn toàn 4,6 gam Na vào 100 gam H20 thu được dung dịch D. Tính nồng độ %, nồng độ mol/I
của dung dịch D.
VD5: Hoà tan hoàn toàn 2,74 gam Ba vào 200 gam H2O thu được dung dịch E. Tính nồng độ %, nồng độ mol/l
của dung dịch E.
VD6: Hoà tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400ml H2O thu đưoc dung dịch F. Tính nồng đo %,
nồng đo mol/l của dung dịch F.
VD1:
\(n_{KCl}=\dfrac{7,45}{74,5}=0,1\left(mol\right)\\ V_{ddKCl}=V_{H_2O}=200\left(ml\right)=0,2\left(l\right)\\ C_{MddKCl}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

a) Ta có: \(n_{NaCl}=\dfrac{5,85}{58,5}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,1}{0,5}=0,2\left(M\right)=\left[Na^+\right]=\left[Cl^-\right]\)
b) Ta có: \(n_{Ba\left(OH\right)_2}=\dfrac{34,2}{171}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{Ba\left(OH\right)_2}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\) \(\Rightarrow\left\{{}\begin{matrix}\left[Ba^{2+}\right]=0,4\left(M\right)\\\left[OH^-\right]=0,8\left(M\right)\end{matrix}\right.\)
c) Ta có: \(n_{H_2SO_4}=0,025\cdot2=0,05\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,05}{0,125+0,025}\approx0,33\left(M\right)\) \(\Rightarrow\left\{{}\begin{matrix}\left[H^+\right]=0,66\left(M\right)\\\left[SO_4^{2-}\right]=0,33\left(M\right)\end{matrix}\right.\)
Đổi \(200ml=0,2l\)
Số mol của 5,85g NaCl là:
\(n_{NaCl}=\dfrac{m_{NaCl}}{M_{NaCl}}=\dfrac{5,85}{58,5}=0,1\left(mol\right)\)
Nồng độ mol của \(5,85g\) \(NaCl\) là:
\(C_MNaCl=\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)