Bằng phương pháp hoá học hãy phân biệt 3 dung dịch đựng trong từng lọ sau: Na2SO4, HCl, H2SO4. Viết PTHH xảy ra.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Nhúng quỳ tím vào 3 lọ. Nếu:
+ Quỳ tím chuyển đỏ thì dd ban đầu là H2SO4(l) và HCl (nhóm 1)
+ Quỳ tím không chuyển màu thì dd ban đầu là Na2SO4, dán nhãn
- Lấy ở nhóm 1 mỗi dd một lượng vừa đủ cho vào 2 ống nghệm riêng biệt.
- Nhỏ từ từ vài giọt dd BaCl2 vào 2 ống nghiệm trên.Nếu:
+ Ống nghiệm xuất hiện kết tủa trắng thì dd ban đầu là H2SO4(l), dán nhãn
+ Không có hiện tượng gì là dd HCl
PTHH: BaCl2 + H2SO4(l) → BaSO4↓ + 2HCl

\(NaOH\left(B\right);Na_2SO_4\left(M\right);HCl\left(A\right);H_2SO_4\left(A\right)\)
`-` Trích mẫu thử
`-` Nhỏ lần lượt các mẫu thử lên giấy quỳ tím:
`+` Quỳ tím hóa đỏ `-> HCl,H_2SO_4` `(1)`
`+` Quỳ tím hóa xanh `-> NaOH` (nhận)
`+` Quỳ tím không đổi màu `-> Na_2SO_4` (nhận)
`-` Lần lượt cho dung dịch `BaCl_2` vào `2` mẫu thử ở nhóm `(1)`
`+` Xuất hiện kết tủa màu trắng `->H_2SO_4`
`PT:BaCl_2 + H_2SO_4 -> BaSO_4 + 2HCl`
`+` Không có dấu hiệu phản ứng `-> HCl`.

Có nhiều cách nhận biết, sau đây là một thí dụ.
- Dùng quỳ tím nhận biết được dung dịch NaOH (quỳ tím chuyển sang xanh), dung dịch Na 2 SO 4 (không đổi màu quỳ tím) và nhóm 2 axit (quỳ tím chuyển sang đỏ).
- Dùng hợp chất của bari, như BaCl 2 hoặc Ba NO 3 2 hoặc Ba OH 2 để phân biệt HCl với H 2 SO 4 nhờ có phản ứng tạo kết tủa trắng.
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl

a)
- Cho các dd tác dụng với quỳ tím:
+ Quỳ tím chuyển đỏ: H2SO4
+ Quỳ tím chuyển xanh: KOH
+ Quỳ tím không chuyển màu: Na2SO4, NaCl
- Cho 2 dd còn lại tác dụng với dd BaCl2
+ Kết tủa trắng: Na2SO4
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)
+ Không hiện tượng: NaCl
b)
- Cho các dd tác dụng với quỳ tím:
+ Quỳ tím chuyển xanh: Ba(OH)2, KOH (1)
+ Quỳ tím chuyển đỏ: H2SO4, HNO3 (2)
+ Quỳ tím không chuyển màu: NaCl, NaNO3 (3)
- Cho dd ở (1) tác dụng với dd Na2SO4:
+ Kết tủa trắng: Ba(OH)2
\(Ba\left(OH\right)_2+Na_2SO_4\rightarrow BaSO_4\downarrow+2NaOH\)
+ Không hiện tượng: KOH
- Cho 2 dd ở (2) tác dụng với dd BaCl2
+ Kết tủa trắng: H2SO4
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
+ Không hiện tượng: HNO3
- Cho 2 dd ở (3) tác dụng với dd AgNO3
+ Kết tủa trắng: NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
+ Không hiện tượng: NaNO3

2.-Trích mỗi lọ một ít làm mẫu thử
-cho Cu tác dụng từng chất, nhận ra HNO3 có khí không màu hóa nâu trong không khí(NO).Nhận ra AgNO3 và HgCl2 vì pư tạo dung dịch màu xanh.
-Dùng dung dịch muối Cu tạo ra, nhận ra được NaOH có kết tủa xanh lơ.
Dùng Cu(OH)2 để nhận ra HCl làm tan kết tủa.
-Dùng dd HCl để phân biệt AgNO3 và HgCl2 ( có kết tủa trắng là AgNO3 )
PTHH:3Cu + 8HNO3 -->3Cu(NO3)2 + 4H2O + 8NO
2AgNO3 + Cu --> 2Ag + Cu(NO3)2
Cu + HgCl2 --> CuCl2 + Hg
NaOH + Cu(NO3)--> Cu(OH) + NaNO3
Cu(OH)2 + 2HCl--> CuCl2 + 2H2O
AgNO3 +HCl--> AgCl+ HNO3
1) * Trích mỗi ống nghiệm một ít hóa chất đánh dấu làm mẫu thử
- Cho một mẩu quỳ tím vào 3 mẫu thử
+ Nếu dung dịch nào làm quỳ tím ngả màu xanh là dung dich HCl
+ Nếu mẫu thử làm cho quỳ tím ngả màu đỏ là dung dịch H2SO4
- Còn lại là HNO3

- Dùng quỳ tím nhận biết được HCl, H 2 SO 4 (nhóm I) và NaCl, Na 2 SO 4 (nhóm II).
- Phân biệt hai axit trong nhóm I bằng muối bari như BaCl 2 , Ba NO 3 2 hoặc bằng Ba OH 2
- Phân biệt hai muối trong nhóm II cũng dùng hợp chất của bari như đã nói ở trên.

- Dùng quỳ tím:
+ Hóa xanh -> dd NaOH
+ Hóa đỏ -> dd HCl, dd H2SO4 -> Nhóm I
+ Không đổi màu -> dd BaCl2, dd Na2SO4 -> Nhóm II
- Dùng dd BaCl2 cho nhóm I:
+ Kết tủa trắng BaSO4 -> Nhận biết dd H2SO4
+ Không có kt -> dd HCl
- Dùng dd H2SO4 cho nhóm II:
+ Có kt trắng BaSO4 -> dd BaCl2
+ Không có kt -> dd Na2SO4
PTHH: H2SO4 + BaCl2 -> BaSO4 (kt trắng) + 2 HCl

A. Trích mẫu thử:
- Cho quỳ tím vào mỗi mẫu thử
+ Nếu quỳ tím hóa đỏ là H2SO4
+ Nếu quỳ tím hóa xanh là NaOH
+ Nếu quỳ tím không có phản ứng là NaCl và Na2SO4
- Cho dung dịch BaCl2 vào NaCl và Na2SO4
+ Nếu có kết tủa trắng không tan trong nước mà axit là Na2SO4
PTHH: Na2SO4 + BaCl2 ---> BaSO4↓ + 2NaCl
+ Không có phản ứng là NaCl
B. Trích mẫu thử:
- Cho quỳ tím vào mỗi mẫu thử.
+ Nếu quỳ tím hóa đỏ là HCl và H2SO4
+ Nếu quỳ tím hóa xanh là NaOH
+ Nếu quỳ tím không đổi màu là KCl
- Cho dung dịch BaCl2 vào HCl và H2SO4
+ Nếu có kết tủa màu trắng không tan trong axit và nước là H2SO4
PTHH: H2SO4 + BaCl2 ---> BaSO4↓ + 2HCl
+ Không có hiện tượng là HCl
\(a/\\ \text{Cho quỳ tím vào 4 mẫu:}\\ \text{- Hoá đỏ: } H_2SO_4\\ \text{- Hoá xanh: } NaOH\\ \text{- Không hiện tượng: } NaCl; Na_2SO_4\\ \text{Tiếp tục cho } BaCl_2 \text{ vào nhóm không hiện tượng}\\ \text{- Kết tủa trắng: } Na_2SO_4\\ \text{- Không hiện tượng: } NaCl\\ Na_2SO_4+BaCl_2 \to BaSO_4+2NaCl\\ b/\\ \text{Cho quỳ tím vào 4 mẫu:}\\ \text{- Hoá đỏ: } H_2SO_4; HCl\\ \text{- Hoá xanh: } NaOH\\ \text{- Không hiện tượng: } KCl\\ \text{Tiếp tục cho } BaCl_2 \text{ vào nhóm hoá đỏ}\\ \text{- Kết tủa trắng: } H_2SO_4\\ \text{- Không hiện tượng: } HCl\\ H_2SO_4+BaCl_2 \to BaSO_4+2HCl \)
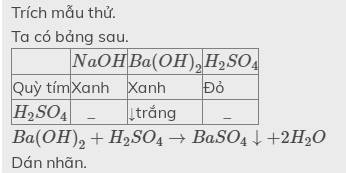

- Lấy mẫu thử các dung dịch và đánh số
- Nhúng quỳ tím lần lượt vào các dung dịch trên, dung dịch nào làm quỳ tím hóa màu đỏ là \(HCl,H_2SO_4\), dung dịch nào không làm quỳ đổi màu là \(Na_2SO_4\)
- Cho dung dịch \(Ba(OH)_2\) vào hai dung dịch còn lại, dung dịch nào xuất hiện kết tủa là \(H_2SO_4\), còn lại là \(HCl\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
Viết pthh nx