khối lượng nguyên tử của b bằng 10.81. b trong tự nhiên gồm hai đồng vị 10b và 11b. hỏi có bao nhiêu phần trăm 11b trong axit boric H3BO. Cho H3BO3 = 61,81
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
• Giả sử % của 10B và 11B trong tự nhiên lần lượt là x, y.
Ta có hpt:
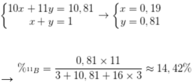

Đáp án D
• Giả sử % nguyên tử 11B và 10B trong tự nhiên lần lượt là x, y.
Ta có hpt:
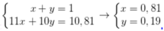
Nếu có 1539 nguyên tử 10B thì có
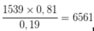 nguyên tử 11B.
nguyên tử 11B.

x là phần trăm của 10B.
Khối lượng trung bình 10,82= \(\frac{10x+11\left(100-x\right)}{100}\)
Tính ra %10B = 18%. %11B= 82%.
Tỉ lệ \(\frac{\%10B}{\%11B}=\frac{9}{41}\)
Từ tỉ lệ này tính thì 73 nguyên tử 10B có \(\frac{73\cdot41}{9}\simeq332.5\) nguyên tử 11B.
Thế kết quả vào kiểm tra lại Khối lượng trung bình của B là 10,8199 .
Chúc bạn học học tốt![]()

còn cách nx nè :
đầu tiên bạn giải tìm % của từng đồng vị dùng công thức nguyên tử khối trung bình
kết quả: 10/5 b bằng 19%
11/5 b bằng 81%
% b trong axit h3bo3 là 10,81:(3+10,81+48)100=17,5%
ta có 100% thì có 81%đồng vị 11/5
=> 17,5% có 14,175%đồng vị 11/5
đáp số là 14,175%
gọi x là % đồng vị 10/5
=>%đồng vị 11/5 là 100 - x
ta có:
(10x + 11(100 - x))/100=10,81
<=>x=19%
=>%đồng vị 11/5=81%
ta có: M H3B03=61,81
=>% B trong H3B03 là:
(10,81/61,81)*100%=17,5%
=>%đồng vị 11/5 trong H3B03 là:
(81*17,5)/100%=14,175 %

gọi x là % đồng vị 10/5
=>%đồng vị 11/5 là 100 - x
ta có:
(10x + 11(100 - x))/100=10,81
<=>x=19%
=>%đồng vị 11/5=81%
ta có: M H3B03=61,81
=>% B trong H3B03 là:
(10,81/61,81)*100%=17,5%
=>%đồng vị 11/5 trong H3B03 là:
(81*17,5)/100%=14,175 %

Đáp án A
Giả sử % 10B và % 11B trong tự nhiên lần lượt là x, y.
Ta có hpt:
![]()
Vậy phần trăm số nguyên tử đồng vị 10B trong H3BO3 là
![]()