cho m1 gam al vào 100ml hỗn hợp agno3 0.,3 M ,Cuso4 0,2 M. sau pu xảy ra hoàn toàn thu được m2 (g) chất rắn. cho m2 (g)rắn vào dd HCl dư thì có 0,336(l) khí thoát ra (đktc). tính m1 m2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Do X tác dụng được với HCl ⇒ Al dư. Bảo toàn electron: nAl dư = 0,01 mol.
Bảo toàn gốc NO3: nNO3–/dung dịch sau = 0,09 mol. Bảo toàn điện tích: nAl3+ = 0,03 mol.
► Bảo toàn nguyên tố Al: m1 = 27 × (0,03 + 0,01) = 1,08(g). Lại có :
X gồm 0,03 mol Cu; 0,03 mol Ag và 0,01 mol Al dư ||⇒ m2 = 5,43(g)
⇒ chọn A

Đáp án C
Do X tác dụng với HCl sinh ra khí nên Al dư, CuSO4 và AgNO3 hết
nAl dư=nH2/1,5=0,02 mol
nCu=nCuSO4=0,03 mol
nAg=nAgNO3=0,03 mol
BT e: 3nAl pư=2nCu+nAg=> nAg pư=(0,03.2+0,03)/3=0,03 mol
m1=(0,03+0,02).27=1,35 gam
m2=0,03.64+0,03.108+0,02.27=5,7 gam

Đáp án A
Vì Al(OH)3 là 1 hyđroxit lưỡng tính
⇒ có thể tác dụng với axit và bazo.
Cho X vào HCl mà tạo khí thì trong X chắc chắn có Al (do Cu và Ag không phản ứng với HCl).
Do có Al nên Cu2+ và Ag+ phản ứng hết.
Số mol Al ban đầu:
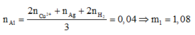
![]()

Chọn đáp án A
Chất rắn X có thể có Al, Cu và chắc chắn có Ag.
Cho X vào HCl mà tạo khí thì trong X chắc chắn có Al (do Cu và Ag không phản ứng với HCl).
Do có Al nên Cu2+ và Ag+ phản ứng hết.
Số mol Al ban đầu:
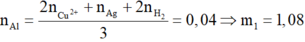
![]()
⇒ Chọn A

Thứ tự p/ư xảy ra
Al+ 3AgNO3------>Al(NO3)3+ 3Ag↓ (1)
0.01....0.03...................0.01........0.03
2Al+ 3Cu(NO3)2------>2Al(NO3)3+ 3Cu↓ (2)
0.02......0.03.....................0.02............0.03
Vì có khí H2 thoát ra chứng tỏ Al dư
2Al+ 6HCl-------> 2AlCl3+ 3H2(3)
0.01.....0.03..............0.01......0.015
nH2=0.015 mol
nAgNO3=nCu(NO3)2=0.03 mol
Ta có: ΣnAl=0.01+0.02+0.01=0.04 mol
=> m1=0.04*27=1.08 g
Rắn X gồm Cu, Ag và Al dư
=>m2=0.03*64+0.03*108+0.01*27=5.43 g

Chọn C
m2 gam X có thể phản ứng với HC1 tạo H2 Þ Có Al dư Þ nAl dư = 0,03/1,5 = 0,02
Vì AI dư Þ Toàn bộ Ag+ và Cu2+ đã bị khử hết về kim loại đơn chất
BTE Þ 3nAl phản ứng = 0,03x2 + 0,03 = 0,09 Þ nAl phản ứng = 0,03
Vậy m1 = (0,03 + 0,02)x27 = 1,35; m2 = 0,02x27 + 0,03x64 + 0,03x108 = 5,7



vì có khí thoát ra ⇒Al dư
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015mol\\ n_{AgNO_3}=0,3.1=0,3mol\\ n_{CuSO_4}=0,2.1=0,2mol\)
\(Al+3AgNO_3\rightarrow3Ag+Al\left(NO_3\right)_3\)
0,1 0,3 0,3
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
\(\dfrac{2}{15}\) 0,2 \(\dfrac{1}{15}\) 0,2
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,01 0,015
\(m_1=m_{Al}=\left(0,01+0,1+\dfrac{2}{15}\right)27=6,57g\)
\(m_2=0,01.27+0,3.108+0,2.64=45,47g\)
số mol mik ghi là số mol pư nhé