Cho 20 gam hỗn hợp Cu và Al phản ứng với dd H2SO4 loãng, dư thấy được 1,344l khí (đktc).
Tính % theo khối lượng Al và Cu trong hỗn hợp đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) \(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
_____0,02<---0,03<---------------------0,03
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,02.27}{2,16}.100\%=25\%\\\%Cu=100\%-25\%=75\%\end{matrix}\right.\)
c) mH2SO4 = 0,03.98 = 2,94 (g)
=> \(C\%\left(H_2SO_4\right)=\dfrac{2,94}{200}.100\%=1,47\%\)

Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Cu + H2SO4 ---x--->
Mg + H2SO4 ---> MgSO4 + H2
Theo PT: \(n_{Mg}=n_{H_2}=0,1\left(mol\right)\)
=> \(m_{Mg}=0,1.24=2,4\left(g\right)\)
=> \(m_{Cu}=10-2,4=7,6\left(g\right)\)
=> \(\%_{m_{Cu}}=\dfrac{7,6}{10}.100\%=76\%\)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
_____0,15<--------------0,15<---0,15
=> mFe = 0,15.56 = 8,4 (g)
=> mCu = 11,6 - 8,4 = 3,2 (g)
\(\left\{{}\begin{matrix}\%Fe=\dfrac{8,4}{11,6}.100\%=72,414\%\\\%Cu=\dfrac{3,2}{11,6}.100\%=27,586\%\end{matrix}\right.\)
mFeSO4 = 0,15.152 = 22,8 (g)

a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g

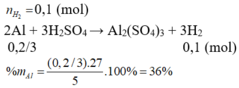
n H2 = 1,344/22,4 = 0,06(mol)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH :
n Al = 2/3 n H2 = 0,04(mol)
Vậy :
%m Al = 0,04.27/20 .100% = 5,4%
%m Cu = 100% -5,4% = 94,6%
Theo gt ta có: $n_{H_2}=0,06(mol)$
Bảo toàn e ta có: $n_{Al}=0,04(mol)$
$\Rightarrow m_{Cu}=18,92(g)$
Do đó $\%m_{Al}=5,4\%;\%m_{Cu}=94,6\%$