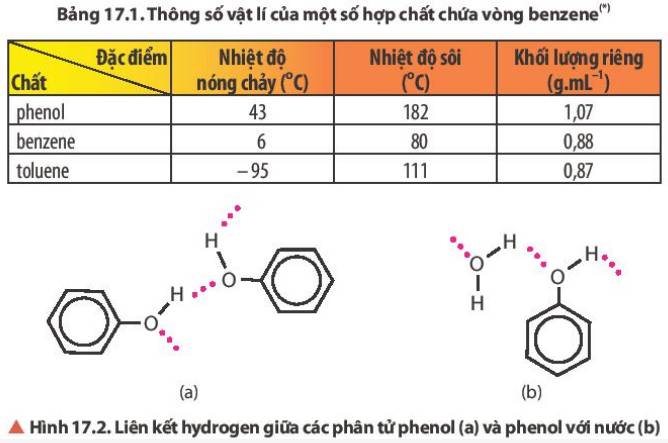
Đọc thông tin trong Bảng 17.1 và Hình 17.2, so sánh nhiệt độ nóng chảy của phenol với các hợp chất còn lại. Giải thích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(M_{benzen}< M_{toulen}< M_{o-xylen}\)
nên nhiệt độ sôi của benzen, toulen, o-xylen tăng dần

Nhiệt độ sôi: butanoic acid > butan – 1 – ol > butanal > butane.
Giải thích:
+ Vì Butanoic acid có nhiệt độ sôi cao nhất trong dãy do butanoic acid có khả năng tạo thành liên kết hydrogen bền vững hơn liên kết hydrogen trong phân tử butan – 1 – ol.
+ Butanal và butane không có liên kết hydrogen nhưng butanal phân cực nên có nhiệt độ sôi cao hơn butane.

So sánh nhiệt độ nóng chảy: Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy.
Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyen tử đều bền vững, khá cững, khó nóng chảy, khó bay hơi.
Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi.

a) Sự nóng chảy: Là quá trình chuyển từ thể rắn sang thể lỏng.
Sự đông đặc là quá trình chuyển từ thể lỏng sang thể rắn.
Sự bay hơi là quá trình chuyển từ thể lỏng sang thể khí.
Sự ngưng tụ là quá trình chuyển từ thể khí sang thể lỏng.
b) Tốc độ bay hơi phụ thuộc vào 3 yếu tố :
-Nhiệt độ càng cao hoặc thấp.
-Gió càng mạnh hoặc yếu.
-Diện tích mặt thoáng của chất lỏng càng lớn hoặc nhỏ
c) Nhiệt độ nóng chảy và nhiệt độ đông đặc của một chất bằng nhau. Trong thời gian nhiệt độ nóng chảy và nhiệt độ đông đặc, nhiệt độ của vật không thay đổi.

a) Công thức phân tử các hợp chất gồm: H2, X2, HX, XX’ (X: F, Cl, Br, I và X’ là halogen có độ âm điện lớn hơn). Tổng 15 chất.
b) H2, X2 là liên kết cộng hóa trị không có cực; HX và XX’ là liên kết cộng hóa trị có cực
c)- Độ bền liên kết: HF >HCl >HBr >HI do độ dài liên kết tăng, năng lượng liên kết giảm.
- Nhiệt độ nóng chảy, nhiệt độ sôi: HF > HCl do HF có liên kết hidro liên phân tử.
- Nhiệt độ nóng chảy, nhiệt độ sôi: HCl < HBr < HI do phân tử khối tăng.
- Tính khử HF < HCl < HBr < HI và tính axit HF < HCl < HBr < HI do độ dài liên kết tăng, năng lượng liên kết giảm.

Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Tham khảo:
Nhiệt độ nóng chảy của toluene < benzene < phenol
Giải thích: Do phân tử phenol có liên kết hydrogen. Mà các chất có liên kết hydrogen càng bền thì nhiệt độ sôi càng cao.