Hãy so sánh lượng nhiệt toả ra nếu đốt cháy C2H4 và C2H2 với số mol bằng nhau.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mC2H2 thực tế=1,4.1000=1400g
=>nC2H2=1400/26=700/13 mol
Mà đốt cháy 1 mol C2H2 nhiệt tỏa ra=432kJ
=>đốt cháy 700/13 mol C2H2 => nhiệt tỏa ra=23261,54kJ

Số mol của axetilen là :
11,2/22,4 x 20/100 = 0,1 mol
Số mol của etilen là :
11,2/22,4 x 80/100 = 0,4 mol
Vậy nhiệt lượng toả ra khi đốt là
(0,1 x 1320) + (0,4 x 1423) = 701,2 (kJ).

Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg etilen là :
1423/28 x 1000g = 50821,4kJ
Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg axetilen là :
1320/26 x 10006 = 50769,2kJ

Đáp án D
hhX gồm C2H2 và H2 có cùng số mol.
hhX cho qua xúc tác nung nóng
→ hhY gồm C2H4, C2H6, C2H2 và H2.
Sục Y vào brom dư
→ mbình tăng = 19 gam và 0,2 mol hh khí có d/H2 = 8,5.
• Theo BTKL:
mhhX = mbình brom tăng + mkhí thoát ra
= 19 + 0,2 x 17 = 22,4 gam.
→ nC2H2 = nH2 = 22,4 : (26 + 2) = 0,8 mol.
• C2H2 + 2,5O2 → 2CO2 + H2O
0,8----------2
H2 + 0,5O2 → H2O
0,8----0,4
→ ∑nO2 = 2 + 0,4 = 2,4 mol
→ VO2 = 2,4 x 22,4 = 53,76 lít

Chọn đáp án D
Ta có mZ = 0,2 × 8,5×2 = 3,4 gam.
Ta có sơ đồ
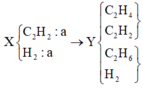
+ Theo định luật BTKL ⇒ mC2H2 + mH2 = 19 + 3,4 = 22,4 gam
⇒ nC2H2 = nH2 = 22,4 ÷ (26 + 2) = 0,8 mol
+ Vì thành phần nguyên tố C và H trong X và Y như nhau.
⇒ Đốt cháy hoàn toàn hh Y hay X thì đều cần 1 lượng oxi như nhau.
Ta có sơ đồ đốt cháy
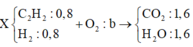
⇒nO2 = b = nCO2 + ½ nH2O = 2,4 mol ⇒ VO2 = 53,76 lít ⇒ Chọn D

Đáp án C
Ta có : mY = mbình tăng + mkhí thoát ra = 10,8 + 0,2.8.2 = 14g = mX ( bảo toàn khối lượng)
Mà trong X số mol C2H2 và H2 băng nhau => nC2H2 = nH2 = 0,5 mol
C2H2 + 2,5O2 -> 2CO2 + H2O
H2 + 0,5O2 -> H2O
=> nO2 = 1,5 mol => V = 33,6 lit
Lượng nhiệt đốt cháy C2H2 lớn hơn lượng nhiệt đốt cháy C2H4 cùng số mol