Xác định bán kính của Ca nếu khối lượng riêng của Ca là 1,55 g/cm3 và nguyên tử khối là 40,08. Biết rằng trong tinh thể các nguyên tử Ca chiếm 74% thể tích trong tinh thể?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


bài 2 : Để so sánh số nguyên tử thì mình có thể thông qua số mol vì
N = n.N0 (N0 là số Avogadro)
n = m/M = DV/M
n(Pt) = 21.45 x 1/195
n(Au) = 19.5 x 1/197
Bạn tự bấm máy tính để ra kq nhe :D
bài 1 : thể tích 1 mol Ca
V=40.08∗0.741.55=6.02∗1023∗4/3∗pi∗R3V=40.08∗0.741.55=6.02∗1023∗4/3∗pi∗R3
trong đó V=m/d=4/3∗pi∗R3V=m/d=4/3∗pi∗R3
còn 6.02∗10236.02∗1023 là số lượng nguyên tử của 1 mol
máy tỉnh bỏ túi solve hoặc giải pt bằng tay là ra R=1.96∗10−8R=1.96∗10−8
với Cu cậu làm tương tự là ra

Thể tích của nguyên tố R: \(V_1=\dfrac{M}{d}\)
Giả thiết rằng, trong tinh thể R các nguyên tử là những hình cầu chiếm 74%
=> Thể tích của tất cả nguyên tử là:\(V_2=V_1.0,74\)
Thể tích của từng nguyên tử là: \(V_3=\dfrac{V_2}{6,023.10^{23}}\)
Mặt khác: \(V_3=\dfrac{4}{3}.pi.R^3=3,178.10^{-23}cm^3\)
\(\Rightarrow M=\dfrac{3,178.10^{-23}.6,023.10^{23}.1,55}{0,74}=40\)
=> R là Ca

Khối lượng riêng của nguyên tử là:
D = 19,36.100/74 = 26,16(g/ cm 3 )
Khối lượng của 1 mol nguyên tử :
M = V.D.N = 4/3π r 3 .D.N = 4/3. 3,14. 1 , 44 . 10 - 8 3 .26,16. 6,022. 10 23 ≈ 197 (g/mol)

Nguyên tử khối là 197.
ta có : nguyên tử khối ≈số khối = P+N
số proton = 197 – 118 = 79
 bài giải đây nha!
bài giải đây nha!

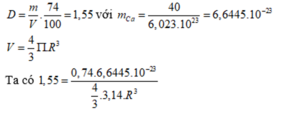
\(V_{1.mol.Ca\left(tinh.thể\right)}=\dfrac{40,08g}{1,55g/cm^3}=25,858cm^3\)
\(V_{thực.sự.1mol.Ca}=25,858.\dfrac{74}{100}=19,135cm^3\)
\(\Rightarrow V_{1.nguyên.tử.Ca}=\dfrac{19,135}{6,023.10^{23}}=3,18.10^{-23}cm^3\)
Giả sử nguyên tử Ca là khối cầu thì: \(V=\dfrac{4}{3}\pi R^3\Rightarrow R=\sqrt[3]{\dfrac{3V}{4\pi}}\)
\(R_{Ca}=\sqrt[3]{\dfrac{3.3,18.10^{-23}}{4.3,14}}=1,97.10^{-8}cm\) hay \(1,97\) \(A^o\)