Hòa tan hoàn toàn 3,9g natri vào nc,thu đc 150ml dung dịch X và khí Y
a vt các PTHH xảy ra
b tính CM của các chất đó trong dung dịch
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`a)`
`Zn+2HCl->ZnCl_2+H_2`
`ZnO+2HCl->ZnCl_2+H_2O`
`b)`
Theo PT: `n_{Zn}=n_{H_2}={2,24}/{22,4}=0,1(mol)`
`->m_{Zn}=0,1.65=6,5(g)`
`->m_{ZnO}=14,6-6,5=8,1(g)`

a:
nFe=11,2/56=0,2(mol)
Fe+2HCl->FeCl2+H2
0,2 0,2
b: V=0,2*22,4=4,48(lít)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{10}.100\%=65\%\\\%m_{ZnO}=35\%\end{matrix}\right.\)
c, \(n_{HCl}=0,1.0,5=0,05\left(mol\right)\)
\(n_{NaOH}=0,03.1=0,03\left(mol\right)\)
PT: \(HCl+NaOH\rightarrow NaCl+H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}>\dfrac{0,03}{1}\), ta được HCl dư.
→ Quỳ tím chuyển đỏ do acid dư.

\(n_{H_2}=\dfrac{4,958}{24,79}=0,2mol\\ a)Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ b)n_{Fe}=n_{FeSO_4}=n_{H_2}=0,2mol\\ m_{Fe}=0,2.56=11,2g\\ c)m_{ddFeSO_4}=11,2+200-0,2.2=210,8g\\ m_{FeSO_4}=0,2.152=30,4g\\ C_{\%_{FeSO_4}}=\dfrac{30,4}{210,8}\cdot100\%=14,42\%\)
a) Viết phương trình hóa học và cân bằng:
\( \mathrm{Fe} + \mathrm{H}_2\mathrm{SO}_4 \rightarrow \mathrm{FeSO}_4 + \mathrm{H}_2 \)
b) Để tính khối lượng sắt đã phản ứng, ta cần biết số mol của khí hydrogen đã thoát ra. Với điều kiện đo ở đkc, 1 mol khí hydrogen có thể chiếm 22.4 L. Vì vậy, số mol khí hydrogen thoát ra là:
\( \text{Số mol } \mathrm{H}_2 = \dfrac{4.958}{22.4} \)
Theo phương trình cân bằng, ta biết rằng 1 mol sắt phản ứng với 1 mol khí hydrogen. Vì vậy, số mol sắt đã phản ứng cũng bằng số mol khí hydrogen:
\( \text{Số mol sắt} = \dfrac{4.958}{22.4} \)
Để tính khối lượng sắt đã phản ứng, ta sử dụng khối lượng mol của sắt:
\( \text{Khối lượng sắt} = \text{Số mol sắt} \times \text{Khối lượng mol sắt} \)
c) Để tính nồng độ phần trăm của dung dịch muối thu được, ta cần biết khối lượng muối thu được và khối lượng dung dịch ban đầu.
Khối lượng muối thu được là khối lượng của muối \( \mathrm{FeSO}_4 \), và khối lượng dung dịch ban đầu là khối lượng của dung dịch \( \mathrm{H}_2\mathrm{SO}_4 \).
Nồng độ phần trăm của dung dịch muối thu được được tính bằng công thức:
\( \text{Nồng độ phần trăm} = \dfrac{\text{Khối lượng muối thu được}}{\text{Khối lượng dung dịch ban đầu}} \times 100\)
Với các giá trị đã tính được ở bước trước, ta có thể tính nồng độ phần trăm của dung dịch muối thu được.

a)
4P + 5O2 → 2P2O5
b)
nP = 3.1:31 = 0,1 mol
Theo tỉ lệ phản ứng => nP2O5 = 1/2 nP = 0,05 mol
<=> mP2O5 = 0,05.142 = 7,1 gam
c) Câu này theo dữ kiện đề bài của em thì phải tính nồng độ mol của dung dịch chứ không phải nồng độ phần trăm. Nếu tính nồng độ phần trăm thì phải là 200 gam chứ không phải 200ml.
P2O5 + 3H2O → 2H3PO4
nH3PO4 = 2nP2O5 = 0,1 mol
=> CH3PO4 = \(\dfrac{0,1}{0,2}\) = 0,5M

Đáp án C.
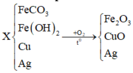
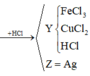
FeCl3 + 3AgNO3 → Fe(NO3)3 + 3AgCl
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
2FeCl3 + Fe → 3FeCl2
![]()
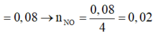
![]()
![]()
a) 2Na + 2H2O $\to$ 2NaOH + H2
b)
Theo PTHH :
n NaOH = n Na = 3,9/23 = 39/230(mol)
=> CM NaOH = \(\dfrac{\dfrac{39}{230}}{0,15} = 1,13M\)
\(n_{Na}=\dfrac{3.9}{23}=\dfrac{39}{230}\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(\dfrac{39}{230}..........\dfrac{39}{230}\)
\(C_{M_{NaOH}}=\dfrac{\dfrac{39}{230}}{0.15}=1.13\left(M\right)\)