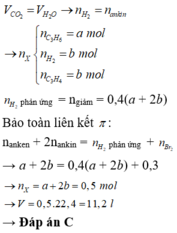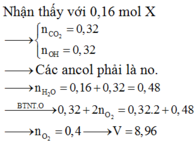Khử hoàn toàn một oxit sắt X ở nhiệt độ cao cần vừa đủ V lít khí CO (ở điều kiện tiêu chuẩn), sau phản ứng thu được 0,84 gam Fe và 0,02 mol khí CO2. a. Tìm công thức của X và giá trị V. b. Hỗn hợp Y gồm X, FeO và Ag (trong đó nguyên tố oxi chiếm 19,2% theo khối lượng). Cho m gam Y tác dụng với 1500 ml dung dịch HCl 3M (dư), thu được dung dịch Z và còn lại 0,248m gam chất rắn không tan. Cho dung dịch Z tác dụng với dung dịch NaOH dư thu được kết tủa T. Đem nung T ngoài không khí đến khối lượng không đổi thu được 100 gam chất rắn khan. Tính m và phần trăm khối lượng từng chất trong hỗn hợp Y. Giúp e với👉👈
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt X:
F e x O y T a c ó n O ( x ) = n C O 2 = n C O = 0 , 02 m o l → V = 0 , 02 . 22 , 4 = 0 , 448 l í t . x : y = n F e : n O ( X ) = 0 , 015 : 0 , 02 = 3 : 4 . V ậ y X l à F e 3 O 4 .
Chọn đáp án B.

Đáp án : D
FexOy + yCO -> xFe + yCO2
=> nFe : nCO2 = 0,015 : 0,02 = x : y
=> x : y = 3 : 4
Oxit sắt là : Fe3O4
nCO = nCO2 = 0,02 mol => V = 0,448 lit

Đáp án B
Đặt công thức oxit sắt là FexOy
FexOy+ yCO → xFe + yCO2
nFe= 0,84/56= 0,015 mol
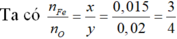
→Công thức oxit là Fe3O4
Ta có: nCO= nCO2= 0,02 mol
→ V= 0,02.22,4= 0,448 lít

Đáp án B.
Đặt công thức oxit sắt là FexOy
Ta có: nFe= 1,12/56= 0,02mol
FexOy+ yCO → xFe+ yCO2
Theo PTHH:
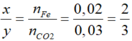
→ Oxit là Fe2O3
Ta có: nCO= nCO2= 0,03 mol→ V= 0,03.22,4= 0,672 lít

\(m_{Cu}=12g\Rightarrow n_{Cu}=\dfrac{12}{64}=0,1875mol\)
\(\Rightarrow m_{Fe}=m_{kl}-m_{Cu}=24-12=12g\Rightarrow n_{Fe}=\dfrac{3}{14}mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
\(\dfrac{12}{64}\) \(\dfrac{12}{64}\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(\dfrac{9}{28}\) \(\dfrac{3}{14}\)
\(\Rightarrow\Sigma n_{H_2}=\dfrac{12}{64}+\dfrac{9}{28}=\dfrac{57}{112}mol\)
\(\Rightarrow V_{H_2}=\dfrac{57}{112}\cdot22,4=11,4l\)

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)