Dùng khí hiđro để khử 32g sắt (III) oxit A.tính khối lượng sắt thu được B.tính thể tích khí hiđro đã dùng ( ở đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


`4H_2 + Fe_3 O_4` $\xrightarrow{t^o}$ `3Fe + 4H_2 O`
`n_{Fe} = (33,6)/56 = 0,6 (mol)`
`a.`
Theo phương trình: `n_{Fe_3 O_4} = 1/3n_{Fe} = 0,2 (mol)`
`-> m_{Fe_3 O_4} = 0,2 . 232 = 46,4 (g)`
`b.`
Theo phương trình: `n_{H_2} = 4/3n_{Fe} = 0,8 (mol)`
`-> V_{H_2} = 0,8 . 22,4 = 17,92 (l)`
`c.`
`2H_2 O` $\xrightarrow{\text{điện phân}}$ `2H_2 + O_2`
Theo phương trình: `n_{H_2 O} = H_2 = 0,8 (mol)`
`-> m_{H_2 O} = 0,8 . 18 = 14,4 (g)`
a) Khối lượng Fe3O4 cần dùng để điều chế 33,6 g Fe:
232 x 0,2 = 46,4 (g)
b) Thể tích khí cần dùng: 0,8 x 22,4 =17,92 (lít).

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{24}{56}=\dfrac{3}{7}\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{3}{14}\left(mol\right)\Rightarrow m_{Fe_2O_3}=\dfrac{3}{14}.160=\dfrac{240}{7}\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=\dfrac{9}{14}\left(mol\right)\Rightarrow V_{H_2}=\dfrac{9}{14}.22,4=14,4\left(l\right)\)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{24}{56}\approx0,43\left(mol\right)\\ a.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
2 3 2 3
0,43 0,645 0,45 0,645
\(b.m_{Fe_2O_3}=n.M=0,43.\left(56.2+16.3\right)=68,8\left(g\right)\\ c.V_{H_2}=n.24,79=0,645.24,79=15,98955\left(l\right).\)

Fe2O3+3H2-to>2Fe+3H2O
0,1125---0,3375----0,225 mol
n Fe=0,225 mol
=>m Fe2O3=0,1125.160=18g
=>VH2=0,3375.22,4=7,56l

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)

a, PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
\(n_{H_2}=3n_{Fe_2O_3}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
b, \(n_{Fe}=2n_{Fe_2O_3}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,2\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,2.160=32\left(g\right)\)
c, \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,6\left(mol\right)\Rightarrow V_{H_2}=0,6.22,4=13,44\left(l\right)\)
d, \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,3\left(mol\right)\Rightarrow V_{O_2}=0,3.22,4=6,72\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=33,6\left(l\right)\)
a)
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
b) $n_{Fe} = \dfrac{22,4}{56} = 0,4(mol)$
Theo PTHH : $n_{Fe_2O_3} = \dfrac{1}{2}n_{Fe} = 0,2(mol)$
$m_{Fe_2O_3} = 0,2.160 = 32(gam)$
c) $n_{H_2} = \dfrac{3}{2}n_{Fe} = 0,6(mol)$
$V_{H_2} = 0,6.22,4 = 13,44(lít)$
d) $2H_2 + O_2 \xrightarrow{t^o} 2H_2O$
$V_{O_2} = \dfrac{1}{2}V_{H_2} = 6,72(lít)$
$V_{kk} = 6,72 : 20\% = 33,6(lít)$

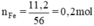
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{32}{160}=0,2\left(mol\right)\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
\(0,6:0,2:0,4:0,6\left(mol\right)\)
\(a,m_{Fe}=n.M=0,4.56=22,4\left(g\right)\)
\(b,V_{H_2}=n.22,4=0,6.22,4=13,44\left(l\right)\)