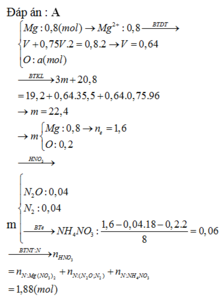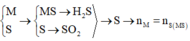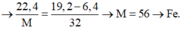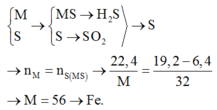Câu 7 (3,0 điểm): Đốt cháy 10,8 gam bột nhôm một thời gian thì thu được m gam chất rắn
A. Hoà tan hoàn toàn chất rắn A bằng lượng vừa đủ dung dịch chứa H2SO4 và HCl (biết số
mol HCl gấp 2 lần số mol H2SO4), sau phản ứng thu được V lít H2 (đktc) và dung dịch B.
Cô cạn dung dịch B thu được (m + 44,34) gam chất rắn khan.
a, Viết phương trình hoá học?
b, Tính m và V?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{4,928}{22,4}=0,22mol\)
\(n_{CuSO_4}=0,66.0,5=0,33mol\)
- Gọi số mol trong phần I là :Fe(x mol), Al(y mol), Ag(z Mol)
- Sỗ mol mỗi kim loại trong phần II: Fe(tx mol), Al(ty mol), Ag(tz Mol)
56(x+tx)+27(y+ty)+108(z+tz)=24,5(*)
- Phần I: Fe+2HCl\(\rightarrow\)FeCl2+H2(1)
2Al+6HCl\(\rightarrow\)2AlCl3+3H2(2)
x+1,5y=0,22(**)
- Phần II: Fe+CuSO4\(\rightarrow\)FeSO4+Cu(3)
2Al+3CuSO4\(\rightarrow\)Al2(SO4)3+3Cu(4)
tx+1,5ty=0,33(***)
152tx+171ty=39,9(****)
- Kết hợp(***) và(****) : tx=0,06, ty=0,18
\(y=3x\)(*****)
- kết hợp (**) và (*****) ta có: x=0,04, y=0,12
\(\rightarrow t=\dfrac{0,06}{0,04}=1,5\)
- Thay x=0,04 ,y=0,12 , t=1,5 vào (*) ta có z=0,04
mI=56x+27y+108z=56.0,04+27.0,12+108.0,04=9,8 gam
số mol Cu=tx+1,5ty=0,33 mol
chất rắn Z gồm 0,33 mol Cu và tz=0,04.1,5=0,06 mol Ag
mZ=0,33.64+0,06.108=27,6 gam

\(m_{SO_4}=m_{muối.sunfat}-m_{kim.loai}=79,44-19,92=59,52\left(g\right)\)
=> \(n_{SO_4}=\dfrac{59,52}{96}=0,62\left(mol\right)\)
=> \(n_{H_2SO_4\left(pư\right)}=0,62\left(mol\right)\)
\(n_{O_2\left(pư\right)}=\dfrac{25,04-19,92}{32}=0,16\left(mol\right)\)
Bảo toàn O: \(n_{H_2O}=0,32\left(mol\right)\)
Bảo toàn H: \(n_{H_2}=\dfrac{0,62.2-0,32.2}{2}=0,3\left(mol\right)\)
=> V = 0,3.22,4 = 6,72 (l)