Cho 5,4 gam Al vào 0,5 mol H2SO4 a)Viết phương trình phản ứng b) Chất nào còn dư,tính khối lượng chất còn dư c)tính thể tích khí H2 thu được ở điều kiện xác định GIÚP MIK VỚI Ạ !
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)

a) $2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
b) $n_{Al} = 0,45(mol) ; n_{H_2SO_4} =\dfrac{219}{980} (mol)$
Ta thấy :
$n_{Al} : 2 > n_{H_2SO_4} : 3$ nên Al dư
Theo PTHH :
$n_{Al\ pư} = \dfrac{2}{3}n_{H_2SO_4} = \dfrac{73}{490} (mol)$
$m_{Al\ dư} = 12,15 - \dfrac{73}{490}.27 = 8,127(gam)$
c) $n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = \dfrac{73}{930}(mol)$
$m_{muối} = \dfrac{73}{930}.342 = 25,48(gam)$
d) $V_{H_2} = \dfrac{219}{980}.22,4 = 5(lít)$
Hình như đề sai
a,\(n_{Al}=\dfrac{12,15}{27}=0,45\left(mol\right)\)
\(m_{H_2SO_4}=109,5.20\%=21,9\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{21,9}{98}=0,2235\left(mol\right)\)

2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----0,3-------0,1------------0,3
n Al=\(\dfrac{5,4}{27}\)=0,2 mol
n H2SO4= \(\dfrac{30}{98}\)=0,306 mol
=>H2SO4 còn dư
=>VH2=0,3.22,4=6,72l
=>m Al2(SO4)3=0,1.342=34,2g
=>m H2SO4 dư=0,006.98=0,588g
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{m_{H_2SO_4}}{M_{H_2SO_4}}=\dfrac{30}{98}=\dfrac{15}{49}mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
2 3 1 3 ( mol )
0,2 15/49 ( mol )
Ta có: \(\dfrac{0,2}{2}< \dfrac{15}{49}:3\)
=> Chất còn dư là \(H_2SO_4\)
\(V_{H_2}=n_{H_2}.22,4=\left(\dfrac{0,2.3}{2}\right).22,4=6,72l\)
\(m_{Al_2\left(SO_4\right)_3}=n_{Al_2\left(SO_4\right)_3}.M_{Al_2\left(SO_4\right)_3}=\left(\dfrac{0,2.1}{2}\right).342=34,2g\)
\(m_{H_2SO_4\left(du\right)}=n_{H_2SO_4\left(du\right)}.M_{H_2SO_4}=\left(\dfrac{15}{49}-\dfrac{0,2.3}{2}\right).98=0,6g\)

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Mình thấy bạn Thịnh tính lượng dư sai
Đây là bài mình từng làm, bạn tham khảo nhé!

\(a/ Mg+H_2SO_4 \to MgSO_4+H_2\\ b/ n_{Mg}=\frac{3,6}{24}=0,15(mol)\\ n_{H_2SO_4}=0,168(mol)\\ b/\\ Mg \text{ hết}; H_2SO_4 \text{ dư}\\ n_{H_2SO_4(dư)}=0,168-0,15=0,018(mol)\\ m_{H_2SO_4}=0,018.98=1,764(g)\\ c/\\ n_{MgSO_4}=0,15(mol)\\ m_{MgSO_4}=0,15.120=18(g)\\ d/\\ n_{H_2}=0,15\\ V=0,15.22,4=3,36(l)\)

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Làm gộp các phần còn lại
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1mol\\n_{H_2SO_4}=n_{H_2}=0,3mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4}=0,3\cdot98=29,4\left(g\right)\end{matrix}\right.\)

a) \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,25 0,5 0,5 0,5
Xét tỉ lệ : \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\) => Zn dư , HCl đủ
b) \(m_{Zn\left(dư\right)}=\left(0,3-0,25\right).65=3,25\left(g\right)\)
c) \(m_{ZnCl_2}=0,25.136=34\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ a,Zn+2HCl\rightarrow ZnCl_2+H_2\\b, Vì:\dfrac{0,5}{2}< \dfrac{0,3}{1}\Rightarrow Zndư\\ n_{Zn\left(dư\right)}=0,3-\dfrac{0,5}{2}=0,05\left(mol\right)\\ \Rightarrow m_{Zn\left(dư\right)}=0,05.65=3,25\left(g\right)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,25.136=34\left(g\right)\\ V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH : Fe + 2HCl -> FeCl2 + H2
0,2 0,4 0,2
Xét tỉ lệ \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\) => Fe đủ , HCl dư
\(m_{HCl\left(dư\right)}=\left(0,5-0,4\right).36,5=3,65\left(g\right)\)
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
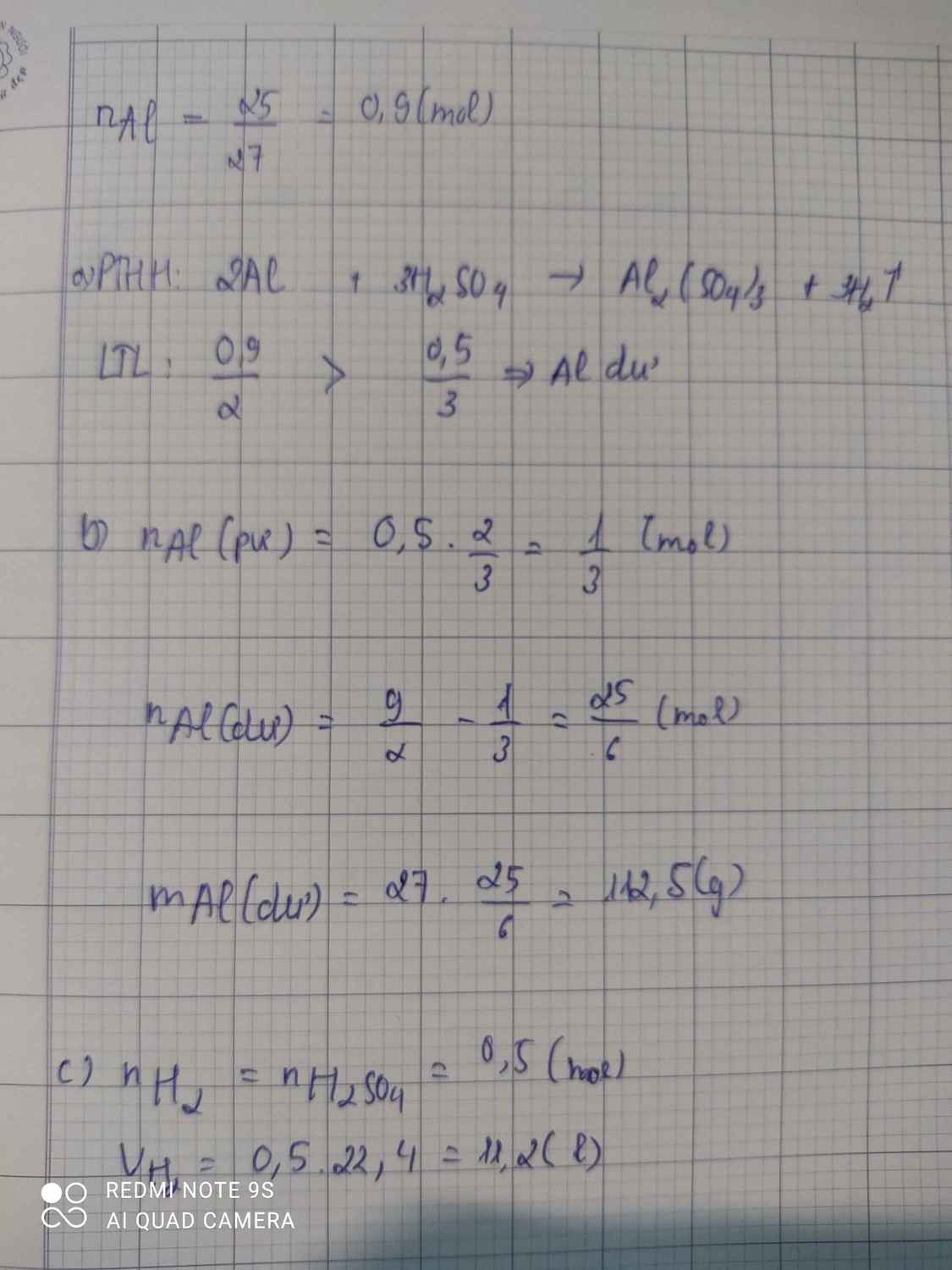
Chúc bạn học tốt!