Cho 11,2 lít khí hiđro tác dụng với CuO thu được kim loại đồng màu đỏ gạch và hơi nước a) Viết PTHH b) Tính khối lượng đồng thu được sau phản ứng c) Thể tích hơi nước thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{2,4}{22,4}\approx0,11\left(mol\right)\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{1,6}{22,4}\approx0,07\)
\(2H_2+O_2\rightarrow2H_2O\)
2 mol-1mol---2 mol
Ta có: \(\dfrac{n_{H_2}}{2}=\dfrac{0,11}{2}\)
\(\dfrac{n_{O_2}}{1}=\dfrac{0,07}{1}\)
\(\Rightarrow\dfrac{n_{H_2}}{2}< \dfrac{n_{O_2}}{1}\)
Vậy \(O_2\) dư
Số mol O2 dư:
\(n_{O_2}=\dfrac{0,07.1}{2}=0,035\left(mol\right)\)
Khối lượng O2 dư
\(m_{O_2}=0,035.32=1,12\left(g\right)\)
Khối lượng nước thu được:
\(n_{H_2O}=\dfrac{0,07.2}{2}=0,07\left(mol\right)\)
\(\Rightarrow m_{H_2O}=n_{H_2O}.M_{H_2O}=0,07.18=1,26\left(g\right)\)

a) PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(2mol\) \(6mol\) \(2mol\) \(3mol\)
\(0,27\) \(x\) \(y\) \(z\)
b) ta có: \(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{7,3}{27}=0,27\left(mol\right)\)
theo PT: \(n_{Al}=n_{AlCl_3}=0,27\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=n_{AlCl_3}.M_{AlCl_3}=0,27.133,5=36,045\left(g\right)\)
c) ta có: \(n_{H_2}=\dfrac{m_{H_2}}{M_{H_2}}=\) \(\dfrac{0,27.3}{2}=0,405\left(mol\right)\)
\(\Rightarrow V_{H_2\left(đktc\right)}=n_{H_2}.22,4=0,405.22,4=9,072\left(l\right)\)

a) Na nóng chảy, chạy trên mặt nước, tan dần và có khí không màu thoát ra
PTHH: 2Na + 2H2O --> 2NaOH + H2 (pư oxi hóa-khử)
b) Sau pư, thu được dd bazo nên quỳ tím chuyển màu xanh
c) \(n_{H_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,5<----------------0,5<---0,25
=> mNa = 0,5.23 = 11,5 (g)
d) Sản phẩm tạo thành là NaOH (sodium hydroxide) và H2(hydrogen)
mNaOH = 0,5.40 = 20 (g)
mH2 = 0,25.2 = 0,5 (g)

\(H_2+CuO\rightarrow\left(t^o\right)Cu+H_2O\)
0,2 0,2 0,2 0,2
\(b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
\(m_{CuO}=0,2.80=16\left(g\right)\)
\(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
\(m_{H_2O}=0,2.18=3,6\left(g\right)\)

\(n_{CO_2}=\dfrac{5,6}{22,4}=0,25mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,25 0,5 0,25 ( mol )
\(m_{CH_4}=0,25.16=4g\)
\(V_{O_2}=0,5.22,4=11,2l\)

Câu 1 :
a) PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\) (1)
\(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)(2)
b) Ta có : \(n_{Zn}=\frac{3,5}{65}\approx0,054\left(mol\right)\)
Theo phương trình hóa học (1) :
\(n_{H_2}=n_{Zn}\approx0,054\left(mol\right)\)
\(\Rightarrow V_{H_2}\approx0,054\cdot22,4=1,2096\left(l\right)\)
c) Theo phương trình hóa học (2), ta có:
\(n_{Cu}=n_{H_2}\approx0,054\left(mol\right)\)
\(\Rightarrow m_{Cu}\approx0,054\cdot64=3,456\left(g\right)\)
Bài 2:
a) Ta có : \(n_{Al}=\frac{2,7}{27}=0,1\left(mol\right)\); \(n_{HCl}=\frac{200\cdot7,3}{100\cdot36,5}=0,4\left(mol\right)\)
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo phương trình hóa học : \(n_{H_2}=\frac{3}{2}n_{Al}=\frac{3}{2}.0,1=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)
b) Theo phương trình hóa học , ta có : \(n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,1\cdot133,5=13,35\left(g\right)\)
Lại có: \(m_{H_2}=0,15\cdot2=0,3\left(g\right)\)
Áp dụng định luật bảo toàn khối lượng, ta có:
\(m_{Al}+m_{dd_{HCl}}=m_{dd_{AlCl_3}}+m_{H_2}\)
\(\Leftrightarrow2,7+200=m_{dd_{AlCl_3}}+0,3\)
\(\Leftrightarrow m_{dd_{AlCl_3}}=202,4\left(g\right)\)
Vậy \(C\%_{dd_{AlCl_3}}=\frac{13,35}{202,4}\cdot100\%\approx6,6\%\)
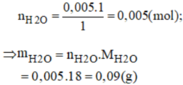

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
a) \(H_2+CuO\rightarrow Cu+H_2O\)
0,5---0,5-------0,5----0,5
Khối lượng đồng thu được:
\(m_{Cu}=n_{Cu}.M_{Cu}=0,5.64=32\left(g\right)\)
Thể tích hơi nước sau phản ứng:
\(V_{H_2O}=n_{H_2O}.22,4=0,5.22,4=11,2\left(l\right)\)