(3 điểm). Dẫn 5,6 lít (đktc) hỗn hợp khí X gồm metan và etilen đi qua bình đựng dung dịch nước brom, đã làm mất màu hoàn toàn dung dịch có chứa 4 gam brom.
a. Tính %V của mỗi khí trong hỗn hợp X.
b. Đốt cháy hoàn toàn 5,6 lít khí X trên thu được m gam sản phẩm. Giá trị của m là.
c. Tìm khối lượng Fe2O3 cần dùng để phản ứng với CO thu được lượng CO2 bằng với lượng CO2 thu được khi đốt 5,6 lít hỗn hợp khí X.

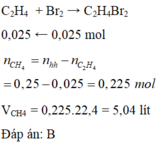
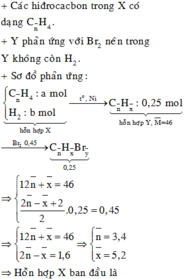
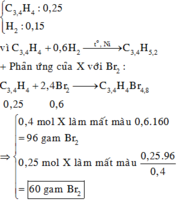
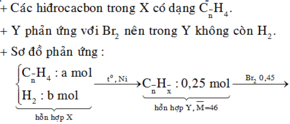
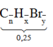
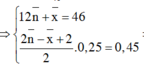
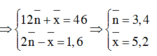

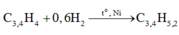

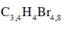
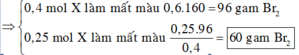
a, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right)\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,025\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,025.22,4}{5,6}.100\%=10\%\\\%V_{CH_4}=90\%\end{matrix}\right.\)
b, Ta có: \(n_{CH_4}=\dfrac{5,6.90\%}{22,4}=0,225\left(mol\right)\)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_4}=0,275\left(mol\right)\)
\(n_{H_2O}=2n_{CH_4}+2n_{C_2H_4}=0,5\left(mol\right)\)
⇒ m sản phẩm = mCO2 + mH2O = 0,275.44 + 0,5.18 = 21,1 (g)
c, PT: \(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{3}n_{CO_2}=\dfrac{11}{120}\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=\dfrac{11}{120}.160=\dfrac{44}{3}\left(g\right)\)
nX = 5,622,4=0,25
0,25 (mol) nBr2 = 4160=0,025
0,025 (mol)
nX = nCH4 + nC2H2
C2H2 + 2Br2 --> C2H2Br4
0,05 <-- 0,025
=> nCH4 = 0,25 - 0,05 = 0,2 (mol)
a. => %VCH4 = 0,20,25.100%=80%0,250,2.100%=80%
=> %VC2H2 = 100% - 80% = 20%
b. Đốt cháy khí X
CH4 + O2 --> CO2 + 2H2O
0,2 0,2 0,4
2C2H2 + 3O2 ---> 4CO2 + 2H2O
0,05 0,1 0,05
nCO2 = 0,2 + 0,1 = 0,3 (mol) => mCO2 = 0,3 .44 = 13,2 (g)
nH2O = 0,4 + 0,05 = 0,45 (mol) => mH2O = 0,45 . 18 = 8,1 (g)
=> m = mCO2 + mH2O = 13,2 + 8,1 = 21,3 (g)
c. nCO2 = 0,3 (mol)
Fe2O3 + 3CO --> 2Fe + 3CO2
0,1 <-- 0,3
nFe2O3 = 0,1 (mol)
=> mFe2O3 = 0,1 . 160 = 16(g)