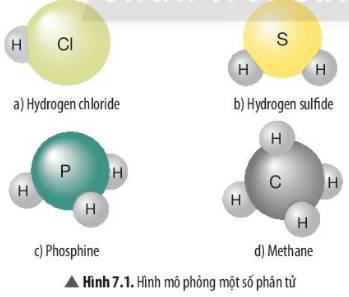
Xác định hóa trị của các nguyên tố Cl, S, P trong các phân tử ở Hình 7.1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nguyên tử Cl có khả năng liên kết với 1 nguyên tử H.
Nguyên tử S có khả năng liên kết với 2 nguyên tử H.
Nguyên tử P có khả năng liên kết với 3 nguyên tử H.
Nguyên tử C có khả năng liên kết với 4 nguyên tử H.

a) Theo quy tắc hóa trị => CTHH: X2O3
b) \(\dfrac{m_X}{m_O}=\dfrac{7}{3}\)
=> \(\dfrac{2.NTK_X}{3.NTK_O}=\dfrac{7}{3}\)
= \(\dfrac{2.NTK_X}{3.16}=\dfrac{7}{3}=>NTK_X=56\left(đvC\right)\)
=> X là Fe
CTHH: Fe2O3

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.

1, Điện hóa trị của các nguyên tố nhóm IA và IIA lần lượt là
+1 và +2
2. Số p = số e = 12
Số n = 12
3,
4,
Cộng hóa trị của cacbon là 4
Cộng hóa trị của hidro là 1

Bài 1:
Liên kết ion: CaO, KCl, BaS
Liên kết cộng hóa trị phân cực: NH3

Trong phân tử mỗi hợp chất ở Bảng 7.1, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia.
H có hoá trị I , 1 nguyên tử H liên kết với 1 nguyên tử Cl => Cl (I)
1 nguyên tử S liên kết với 2 nguyên tử H => S(II)
1 nguyên tử P liên kết với 3 nguyên tử H => P(III)
1 nguyên tử C liên kết với 4 nguyên tử H => C(IV)