Hãy xác định vị trí của aluminium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion aluminium từ nguyên tử aluminium
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


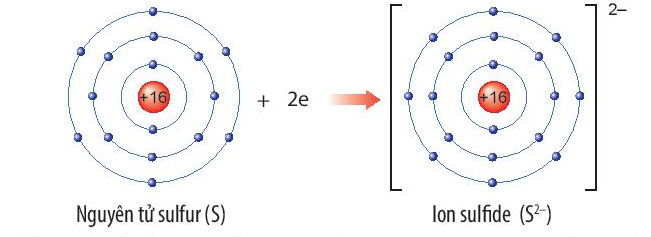
Nguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).

a) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
tỉ lệ: \(4:3:2\)
b) \(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\uparrow\)
tỉ lệ: \(2:1:3\)

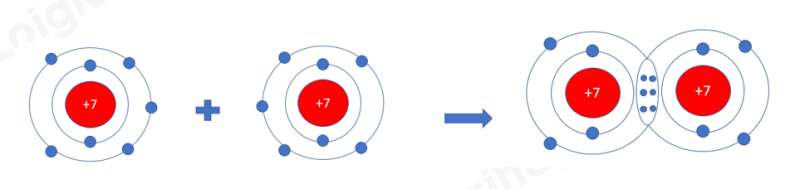
- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
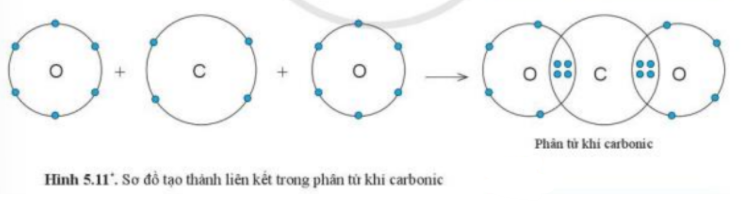
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung

Xác định số nguyên tử có trong:
a) 2 mol nguyên tử nhôm (aluminium).
-> 2.6,022.1023= 12,044.1023 (ngtu)
b) 1,5 mol nguyên tử carbon.
-> 1,5. 6,022.1023= 9,033.1023 (ngtu)
a. 2 mol nguyên tử nhôm (aluminium).
2.6,022.1023 = 12,044.1023(nguyên tử)
b) 1,5 mol nguyên tử carbon.
1,5.6,022.1023 =9,033.1023(nguyên tử)

a) Ta có: p = e; p = 13
=> p = e = 13
- Cấu hình electron trong nguyên tử của nguyên tố Aluminium (Al) là:
+) Lớp thứ nhất: 2 electron
+) Lớp thứ hai: 8 electron
+) Lớp thứ ba: 3 3lectron
b) Vị trí của nguyên tố Aluminium trong bảng tuần hoàn các nguyên tố hóa học:
- Ô: 13
- Chu kì: 3
- Nhóm: IIIA

Phương trình hoá học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
n Al = mAl : M Al = 0,54 : 27 = 0,02 mol
a) Từ phương trình hóa học ta có:
n Al2O3 = ½ n Al = 0,02 : 2 = 0,01 mol
n Al2O3 = 0,01 x 102 = 10,2 gam
b) theo phương trình hóa học ta có:
n O2 = ¾ n Al = ¾ x 0,02 = 0,015 mol
V O2 (đkc) = 0,015 x 24,79 = 0,37185 (lít)
\(PTHH:4Al+3O_2\left(t^o\right)\rightarrow2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\Rightarrow n_{Al}=\dfrac{2}{4}.0,02=0,01\left(mol\right);n_{O_2}=\dfrac{3}{4}.0,02=0,15\left(mol\right)\\ a,m_{Al_2O_3}=0,01.27=0,27\left(g\right)\\ b,V_{O_2\left(đkc\right)}=0,15.24,79=3,7185\left(l\right)\)

Aluminium (Al) thuộc ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Nguyên tử aluminium nhường 3 electron ở lớp ngoài cùng để trở thành ion aluminium, kí hiệu Al3+
Sơ đồ tạo thành ion aluminium: