Dựa vào Bảng 18.1 và Hình 18.1, cho biết nhiệt độ sôi của các hydrogen halide từ HCl đến HI biến đổi như thế nào? Giải thích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Ở điều kiện thường, nhiệt độ là 25oC, tất cả các hydrogen halide đều ở thể khí
=> Khi hạ nhiệt độ xuống thấp dần, hydrogen fluoride sẽ được hóa lỏng đầu tiên

1. Lực càng lớn, momen lực càng lớn lực, tác dụng làm quay càng lớn.
2. Giá của lực càng cách xa trục quay, momen lực càng lớn tác dụng làm quay càng lớn.

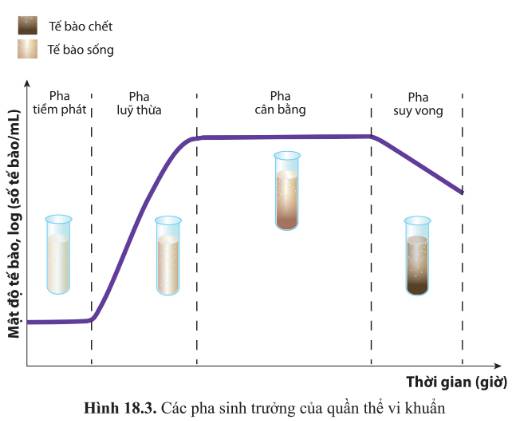
- Ở pha tiềm phát, chất dinh dưỡng đầy đủ mà mật độ quần thể vi khuẩn gần như không thay đổi vì: Ở pha này, vi khuẩn chưa phân chia mà mới bắt đầu thích ứng dần với môi trường, tổng hợp các enzyme trao đổi chất và DNA, chuẩn bị cho quá trình phân bào.
- Sinh khối vi khuẩn đạt cao nhất vào cuối pha lũy thừa, đầu pha cân bằng vì: Vào cuối pha lũy thừa, đầu pha cân bằng, mật độ tế bào vi khuẩn trong quần thể tăng nhanh, quần thể đạt tốc độ sinh trưởng tối đa, số lượng tế bào tăng theo lũy thừa và đạt đến cực đại.
- Số tế bào chết trong quần thể vi khuẩn tăng dần từ pha cân bằng đến pha suy vong do dinh dưỡng thiếu hụt và cạn kiệt, các chất độc hại cho sự sinh trưởng của quần thể vi khuẩn tích lũy tăng dần.

Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.

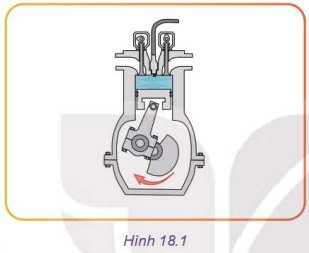
Trục khuỷu quay theo chiều mũi tên, pít tông sẽ chuyển động lên trên; thể tích giảm dần, nhiệt độ và áp suất phía trên đỉnh pít tông tăng dần.

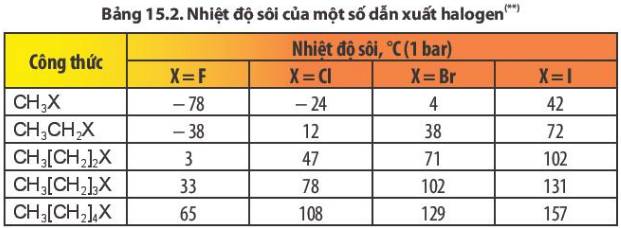
Nhiệt độ sôi của các dẫn xuất halogen tăng dần theo chiều tăng độ dài mạch carbon (cùng loại halogen) và tăng dần theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl)

Từ Bảng 22.2 nhận thấy:
- HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: H-F…H-F…H-F
- Từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng
nhiệt độ sôi tăng từ HI đến HF là do lực tương tác van der Waals giữa các phân tử tăng và khối lượng phân tử tăng.

* Khái niệm: Quy luật phi địa đới là quy luật phân bố không phụ thuộc vào tính chất phân bố theo địa đới của các thành phần và cảnh quan địa lí.
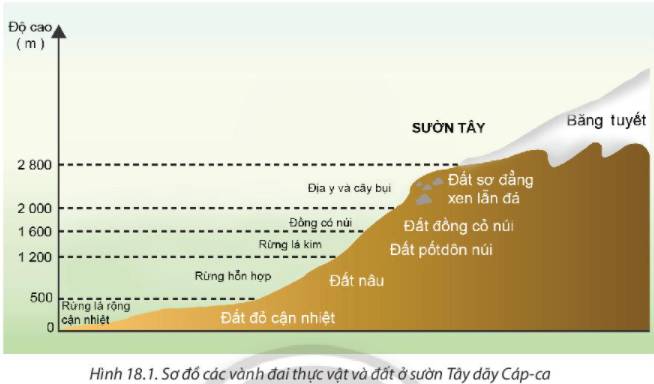
* Ở sườn Tây dãy Cáp-ca (từ chân núi lên đỉnh núi) có những vành đai thực vật và đất sau:
Độ cao (m) | Vành đai thực vật | Vành đai đất |
0-500 | Rừng lá rộng cận nhiệt | Đất đỏ cận nhiệt |
500-1200 | Rừng hỗn hợp | Đất nâu |
1200-1600 | Rừng lá kim | Đất pốt dôn |
1600-2000 | Đồng cỏ núi | Đất đồng cỏ núi |
2000-2800 | Địa y và cây bụi | Đất sơ đẳng xen lẫn đá |
Trên 2800 | Băng tuyết | Băng tuyết |
Sự thay đổi vành đai thực vật và đất theo độ cao là do sự thay đổi nền nhiệt, độ ẩm, lượng mưa theo độ cao -> Làm cho thực vật và đất thay đổi.
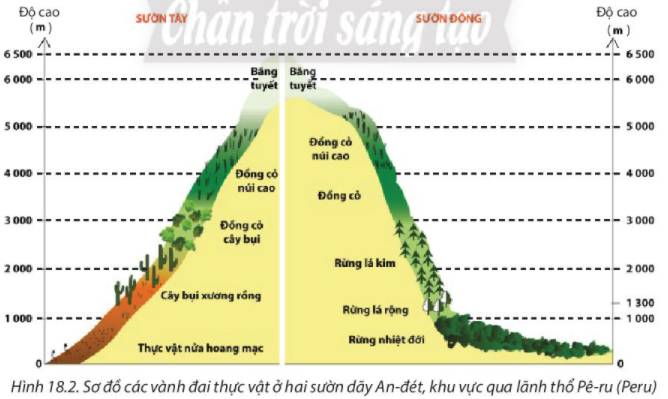
* Sự phân bố đất và thảm thực vật ở sườn Đông và sườn Tây dãy An-đét
Độ cao (m) | Vành đai thực vật | |
Sườn tây | Sườn đông | |
0-1000 | Thực vật nửa hoang mạc | Rừng nhiệt đới |
1000-2000 | Cây bụi xương rồng | Rừng lá rộng, rừng lá kim |
2000-3000 | Đồng cỏ cây bụi | Rừng lá kim |
3000-4000 | Đồng cỏ núi cao | Đồng cỏ |
4000-5000 | Đồng cỏ núi cao | Đồng cỏ núi cao |
Trên 5000 | Băng tuyết | Băng tuyết |
Sự thay đổi các vành đai thực vật ở hai sườn và theo độ cao là do sự thay đổi nền nhiệt, độ ẩm và lượng mưa theo độ cao. Ngoài ra còn do sự khác nhau về khí hậu giữa các sườn núi (sự thay đổi theo hướng núi, hướng sườn).




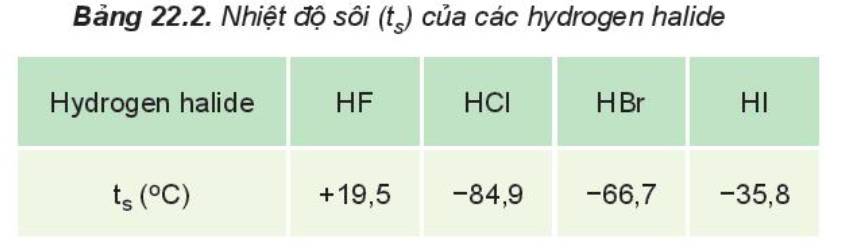
Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng
Nhiệt độ sôi tăng dần từ HCl đến HI
Giải thích:
-M tăng làm tăng năng lượng cần thiết cho quá trình sôi
-sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.