Đốt cháy hoàn toàn 0,23g hợp chất hữu cơ A thu được 0,44g khí CO2 và 0,27g nước. Biết tỉ khối khí của A so với Hiđro là 46. Xác định công thức phân tử của A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
Bảo toán C: nC(A) = 0,15 (mol)
Bảo toàn H: nH(A) = 0,2.2 = 0,4 (mol)
=> \(n_O=\dfrac{2,2-0,15.12-0,4.1}{16}=0\left(mol\right)\)
Xét nC : nH = 0,15 : 0,4 = 3:8
=> CTPT: (C3H8)n
Mà MA = 22.2 = 44(g/mol)
=> n = 1
=> CTPT: C3H8

\(n_C=\dfrac{2,2}{44}=0,05\left(mol\right)\\ n_H=2.\dfrac{1,35}{18}=0,15\left(mol\right)\\ n_O=\dfrac{1,15-0,05.12-0,15}{16}=0,025\left(mol\right)\)
\(CTPT:C_xH_yO_z\\ \Rightarrow x:y:z=0,05:0,15:0,025=2:6:1\\ \Rightarrow\left(C_2H_6O\right)_n=1,4375.32=46\left(\dfrac{g}{mol}\right)\\ \Rightarrow n=1\\ CTPT:C_2H_6O\)

\(n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,6.1 = 4,2 (g) < mA
→ A gồm C, H và O.
⇒ mO = 9 - 4,2 = 4,8 (g) \(\Rightarrow n_O=\dfrac{4,8}{16}=0,3\left(mol\right)\)
Gọi CTPT của A là CxHyOz
⇒ x:y:z = 0,3:0,6:0,3 = 1:2:1
→ CTPT của A có dạng (CH2O)n
Mà: MA = 30.2 = 60 (g/mol)
\(\Rightarrow n=\dfrac{60}{12+1.2+16}=2\)
Vậy: CTPT của A là C2H4O2

\(M_A=14.2=28\left(g/mol\right)\Rightarrow n_A=\dfrac{1,4}{28}=0,05\left(mol\right)\)
Đặt CTPT của A là \(C_xH_y\)
PTHH: \(C_xH_y+\left(x+\dfrac{y}{4}\right)O_2\xrightarrow[]{t^o}xCO_2+\dfrac{y}{2}H_2O\)
0,05----------------------->0,05x--->0,025y
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,05x=\dfrac{4,4}{44}=0,1\left(mol\right)\\n_{H_2O}=0,025y=\dfrac{1,8}{18}=0,1\left(mol\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=2\\y=4\end{matrix}\right.\)
Vậy A là C2H4
Ta có: \(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\Rightarrow n_H=0,1.2=0,2\left(mol\right)\)
Có: mC + mH = 0,1.12 + 0,2.1 = 1,4 (g) = mA
→ A chỉ chứa C và H.
Gọi CTPT của A là CxHy.
⇒ x:y = 0,1:0,2 = 1:2
→ CTPT của A có dạng (CH2)n
Mà: MA = 14.2 = 28 (g/mol)
\(\Rightarrow n=\dfrac{28}{12+2}=2\)
Vậy: CTPT của A là C2H4.

Theo gt ta có: $n_{CO_2}=0,2(mol);n_{H_2O}=0,3(mol)$
Chất A có CTTQ là $C_xH_y$ (vì có 2 nguyên tố)
Ta có: $x:y=0,2:0,6=1:3$
Vậy CTĐGN của A là $(CH_3)_n$
Mà $M_A=30\Rightarrow A=C_2H_6$

nCO2= 0,3(mol) -> nC=0,3(mol)
nH2O =0,25(mol) -> nH=0,5(mol)
mC+mH=0,3.12+0,5.1=4,1(g) < 5,7(g)
=>mO=5,7-4,1=1,6(g) -> nO=0,1(mol)
Gọi CTTQ X: CxHyOz (x,y,z: nguyên, dương)
Ta có: x:y:z= 0,3:0,5:1= 3:5:1
=> CT ĐG nhất X: C3H5O.
b) M(X)=57.2=114(g/mol)
Mà: M(X)=M(C3H5O)a= 57a
<=>114=57a
<=>a=2
=>CTPT X : C6H10O2

Thông thường khi đề bài cho số mol O2 cần để đốt cháy thì chắc chắn ta sẽ phải sử dụng hoặc định luật bảo khối lượng, hoặc bảo toàn nguyên tố Oxi.
Quay trở lại bài toán này, ta thấy đề cho cần dùng 1,904 lít O2, không cho khối lượng CO2 và H2O mà chỉ cho tỉ lệ thể tích (tỉ lệ số mol), do đó nhận ra được nếu ta sử dụng phương pháp bảo toàn khối lượng ta sẽ tính được số mol CO2 và số mol H2O, từ đó tính được số mol O trong A. Tiếp theo đó ta sẽ xác định công thức đơn giản nhất để tìm ra công thức phân tử.
Có: n O 2 = 1 , 904 22 , 4 = 0 , 085 ( m o l ) ⇒ m O 2 = 0 , 085 . 32 = 2 , 72 ( g a m )
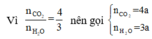
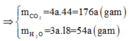
Sơ đồ phản ứng: A + O2 ⇒ CO2 + H2O
Áp dụng định luật bảo toàn khối lượng ta có: m A + m O 2 = m C O 2 + m H 2 O
Hay 1,88 + 2,72 = 176a + 54a ⟺ a = 0,02
⇒ 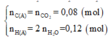
![]()
![]()
Vì C : H : O = nC : nH : nO =0,08 : 0,12 : 0,05 = 8 : 12 : 5
Nên công thức đơn giản nhất của A là C8H12O5.
Khi đó công thức phân tử của A có dạng (C8H12O5)n
Mà MA < 7Mkhôngkhí nên 188n < 7.29 ⇒ n < 1,08 ⇒ n = l
Do đó công thức phân tử của A là C8H12O5.
Đáp án A.

a, Đốt cháy A thu CO2 và H2O nên A chắc chắn gồm C và H, có thể có O.
Ta có: \(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)=n_C\)
\(n_{H_2}=\dfrac{2,7}{18}=0,15\left(mol\right)\Rightarrow n_H=0,15.2=0,3\left(mol\right)\)
Có: mC + mH = 0,15.12 + 0,3.1 = 2,1 (g) < mA
⇒ A gồm C, H và O.
b, Ta có: mO = 4,5 - 2,1 = 2,4 (g) \(\Rightarrow n_O=\dfrac{2,4}{16}=0,15\left(mol\right)\)
Giả sử CTPT của A là CxHyOz.
⇒ x : y : z = 0,15 : 0,3 : 0,15 = 1 : 2 : 1
⇒ CTĐGN của A là (CH2O)n.
Có: MA = 30. 2 = 60 (g/mol)
\(\Rightarrow n=\dfrac{60}{12+2+16}=2\)
Vậy: A là C2H4O2.
c, PT: \(2CH_3CHO+O_2\underrightarrow{Mn^{2+}}2CH_3COOH\)
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(CH_3COONa+NaOH\xrightarrow[t^o]{CaO}CH_4+Na_2CO_3\)
Bạn tham khảo nhé!
Hicc, phần c chỉ có 2 PT cuối thôi ak, bạn bỏ PT đầu đi nhé!

\(n_C=n_{CO_2}=0,4\left(mol\right);n_H=2.n_{H_2O}=2.0,4=0,8\left(mol\right)\\ m_C+m_H=0,4.12+0,8.1=5,6=m_A\)
=> A là hidrocacbon: A chỉ có 2 nguyên tố là C và H
\(a,n_C:n_H=0,4:0,8=1:2\\ \Rightarrow A.có.CTĐG:CH_2\\ b,Đặt.CTTQ:\left(CH_2\right)_a\left(a:nguyên,dương\right)\\ M_{\left(CH_2\right)_a}=28\\ \Leftrightarrow14a=28\\ \Leftrightarrow a=2\\ \Rightarrow CTPT:C_2H_4\)
Ta có MA=46x2=92g/mol
nCO2=0.44:4=4=0.01 (mol)
nH2O=0.27:18=0.015(mol)
trong phân tử chắn chắn có C, H và có thể có O
=>mO=0.23-0.015x2-0.01x12=0.08g
-->nO=0.08:16=0.005(mol)
Nên trong hợp chất có cả C,H và O
Gọi CTDGN (CxHyOz)n
ta có x:y:z=0.01:0.03:0.005=2:6:1
nên CTDGN (C2H6O)n=46n=92----->n=2
CTPT A là C4H12O2
\(n_{CO_2}=n_C=0,01\)
\(n_{H_2O}=0,015\Rightarrow n_H=0,03\)
\(n_O=\dfrac{m_A-12n_C-n_H}{16}=0,005\)
\(n_C:n_H:n_O=0,01:0,03:0,005=2:6:1\)
\(\Rightarrow\left(C_2H_6O\right)_n\)
Mà \(M_A=46\cdot2=92\)
\(\Rightarrow M_{C_2H_6O}\cdot n=92\Rightarrow46n=92\Rightarrow n=2\)
Vật CTPT của A là \(C_4H_{12}O_2\)