: Hòa tan hoàn toàn 7,6g hỗn hợp 2 kim loại thuộc hai chu kỳ kế tiếp trong nhóm IIA bằng 200ml dung dịch HCl aM. Sau phản ứng thu được 6,1975 lít khí (đkc) và dung dịch A. Biết ở (đkc) 1mol khí bất kỳ có thể tích bằng 24,79 lít.
a. Xác định hai kim loại đó?
b. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
c. Tính nồng độ aM của dd HCl đã dùng( biết lượng HCl đã dùng dư 20% so với lượng phản ứng).


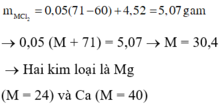



a) \(n_{H_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
Đặt CT chung của 2 kim loại lả R (II)
PTHH: R + 2HCl ---> RCl2 + H2
0,25<-0,5<--------------0,25
=> \(M_R=\dfrac{7,6}{0,25}=30,4\left(g/mol\right)\)
Mà 2 kim loại là 2 kim loại thuộc chu kì liên tiếp trong nhóm IIA
=> 2 kim loại đó lả Mg, Ca
b) Gọi nCa = a (mol); nMg = b (mol)
=> \(\left\{{}\begin{matrix}40a+24b=7,6\\a+b=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,15\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Ca}=\dfrac{0,1.40}{7,6}.100\%=52,63\%\\\%m_{Mg}=100\%-52,63\%=47,37\%\end{matrix}\right.\)
c) \(n_{HCl\left(tổng\right)}=0,5.\left(100+20\right)\%=0,6\left(mol\right)\)
=> \(C_{M\left(HCl\right)}=\dfrac{0,6}{0,2}=3M\)