Cho 14,8 gam hỗn hợp Fe và CuO tác dụng axit H2SO4 (loãng) thu được dung dịch X và 1,12 lít khí (đkc). Cô cạn dung dịch X thu được m(g) muối.
a) Viết phương trình minh hoạ (nếu có).
b) Tính % khối lượng CuO trong hỗn hợp ban đầu.
c) Tính m(g) muối thu được.


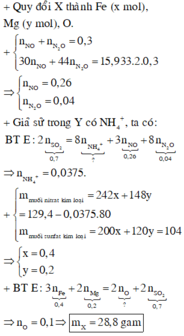
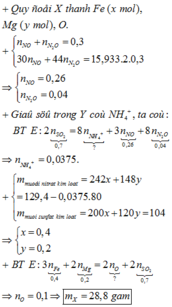



nH2 = 1.12/22.4 = 0.05 (mol)
Fe + H2SO4 => FeSO4 + H2
0.05......................0.05......0.05
mCuO = 14.8 - 0.05 * 56 = 12 (g)
%CuO = 12/14.8 * 100% = 81.08%
nCuO = 12 / 80 = 0.15 (mol)
CuO + H2SO4 => CuSO4 + H2O
0.15..........................0.15
mFeSO4 = 0.05 * 152 = 7.6 (g)
mCuSO4 = 160 * 0.15 = 24 (g)
nH2 = 1.12/22.4 = 0.05 (mol)
Fe + H2SO4 => FeSO4 + H2
0.05......................0.05......0.05
mCuO = 14.8 - 0.05 * 56 = 12 (g)
%CuO = 12/14.8 * 100% = 81.08%
nCuO = 12 / 80 = 0.15 (mol)
CuO + H2SO4 => CuSO4 + H2O
0.15..........................0.15
mFeSO4 = 0.05 * 152 = 7.6 (g)
mCuSO4 = 160 * 0.15 = 24 (g)