1:Dùng phương pháp hoá học nhận biết các dung dịch sau:H2so4,ba(oh)2,naoh.Viết phương trình phản ứng nếu có.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
- Trích mẫu thử
- Cho quỳ tím vào các mẫu thử
+ Quỳ tím hóa đỏ: \(H_2SO_4\)
+ Quỳ tím hóa xanh: \(Ba\left(OH\right)_2,NaOH\)
- Cho \(ddH_2SO_4\) đã nhận biết vào 2 mẫu thử chưa nhận biết
+ Xuất hiện kết tủa trắng: \(Ba\left(OH\right)_2\)
\(PTHH:Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
+ Không hiện tượng: \(NaOH\)
\(PTHH:2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
Câu 2:
\(200ml=0,2l\\ n_{HCl}=C_M.V_{dd}=1.0,2=0,2\left(mol\right)\\ PTHH:2HCl+Ca\left(OH\right)_2\rightarrow CaCl_2+2H_2O\\ \left(mol\right).....0,2\rightarrow.....0,1..........0,1.......0,2\\ V_{ddCa\left(OH\right)_2}=\dfrac{n}{C_M}=\dfrac{0,1}{2}=0,05\left(l\right)\\ V_{ddCaCl_2}=V_{ddHCl}+V_{ddCa\left(OH\right)_2}=0,2+0,05=0,25\left(l\right)\\ C_{M_{CaCl_2}}=\dfrac{n}{V_{dd}}=\dfrac{0,1}{0,25}=0,4\left(M\right)\)

Bài 1:
_ Trích mẫu thử.
_ Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Nếu quỳ tím chuyển đỏ, đó là H2SO4 và HCl. (1)
+ Nếu quỳ tím chuyển xanh, đó là KOH.
+ Nếu quỳ tím không chuyển màu, đó là K2SO4.
_ Nhỏ một lượng mẫu thử nhóm (1) vào ống nghiệm chứa dd BaCl2.
+ Nếu xuất hiện kết tủa trắng, đó là H2SO4.
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_{4\downarrow}\)
+ Nếu không có hiện tượng xảy ra, đó là HCl.
_ Dán nhãn vào từng mẫu thử tương ứng.
Bài 2:
a, \(Na_2O+H_2O\rightarrow2NaOH\)
\(3NaOH+FeCl_3\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(SO_3+H_2O\rightarrow H_2SO_4\)
\(H_2SO_4+Fe\rightarrow FeSO_4+H_2\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Cu+\dfrac{1}{2}O_2\underrightarrow{t^o}CuO\)
Bài 3: Bài này đề bài có thiếu gì không bạn nhỉ?
Bài 1:
- Trích mỗi chất một ít làm mẫu thử
- Nhúng quỳ tím vào các mẫu thử
+ mẫu nào làm quỳ tím hóa đỏ là \(H_2SO_4,HCl\) (nhóm 1)
+ mẫu nào làm quỳ tím hóa xanh là : KOH
+ mẫu nào không làm quỳ tím chuyển màu là \(K_2SO_4\)
- Nhỏ vài giọt dung dịch \(BaCl_2\) vào các mẫu ở nhóm 1
+ mẫu nào xuất hiện kết tủa trắng là \(H_2SO_4\)
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\)
+ không hiện tượng là: HCl
Bài 2:
a. \(Na_2O+H_2O\rightarrow2NaOH\)
\(2NaOH+FeCl_3\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b. \(SO_3+H_2O\rightarrow H_2SO_4\)
\(H_2SO_4+Mg\rightarrow MgSO_4+H_2\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Cu+O_2\underrightarrow{t^o}CuO_2\)
Bài 3: Thiếu dữ kiện nha em
Bài 4:
+) Bazo:
- Bazo của các kim loại đứng trước Mg tan mạng trong nước như: Li, Na, Ba, Ca,...
- Bazo của các kim loại đứng sau Mg không tan trong nước, và bazo của kim loại đứng sau Cu thì bị thủy phân.
+) Muối:
- Muối của kim loại Na,K tan trong nước
- Muối của gốc cacbonat hầu như không tan không nước
- Muối của gốc sunfat hầu như tan không nước trừ \(BaSO_4,Ag_2SO_4\)
- Muối gốc nitrat tan hết trong nước

Trích mẫu thử, cho quỳ tím vào các mẫu thử:
- Quỳ hóa xanh: \(NaOH,Ba(OH)_2\)
- Quỳ ko đổi màu: \(NaNO_3\)
Sục khí \(CO_2\) vào mẫu thử làm quỳ hóa xanh, sau p/ứ tạo KT trắng là \(Ba(OH)_2\), ko ht là \(NaOH\)
\(Ba(OH)_2+CO_2\to BaCO_3\downarrow+H_2O\)

Cho 4 dung dịch thử phản ứng với dung dịch A g N O 3 trong amoniac; dung dịch nào có phản ứng tráng bạc là dung dịch propanal (3 dung dịch còn lại không phản ứng):
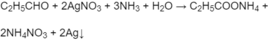
Thử 3 dung dịch còn lại với nước brom, chỉ có axit propenoic làm mất màu nước brom :
![]()
Thử 2 dung dịch còn lại với C a C O 3 , chỉ có axit propanoic hoà tan C a C O 3 tạo ra chất khí:
![]()
Dung dịch cuối cùng là dung dịch propan-1-ol.

- Trích mẫu thử.
- Cho quỳ tím vào các mẫu thử:
+ Nếu quỳ tím hóa đỏ là HCl và H2SO4
+ Nếu quỳ tím hóa xanh là Ba(OH)2
+ Nếu quỳ tím không đổi màu là NaCl
- Cho BaCl2 vào HCl và H2SO4:
+ Nếu có kết tủa trắng không tan trong môi trường nước và axit là H2SO4
H2SO4 + BaCl2 ---> BaSO4↓ + 2HCl
+ Không có phản ứng là HCl.

- Trích mẫu thử.
- Nhỏ từng mẫu thử vào quỳ tím.
+ Quỳ hóa xanh: NaOH
+ Quỳ hóa đỏ: H2SO4
+ Quỳ không đổi màu: Na2SO4, BaCl2 (1)
- Cho mẫu thử nhóm (1) pư với dd H2SO4 vừa nhận biết được
+ Có tủa trắng: BaCl2
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_4\)
+ Không hiện tượng: Na2SO4
- Dán nhãn.
\(NaOH\left(B\right);H_2SO_4\left(A\right);Na_2SO_4\left(M\right);BaCl_2\left(M\right)\)
`-` Trích mẫu thử
`-` Nhỏ lần lượt các mẫu thử lên giấy quỳ tím
`+` Quỳ tím hóa xanh `-> NaOH` (nhận)
`+` Quỳ tím hóa đỏ `-> H_2SO_4` (nhận)
`+` Quỳ tím không đổi màu `-> Na_2SO_4 , BaCl_2` `(1)`
`-` Lần lượt cho dung dịch `BaCl_2` vào `2` mẫu thử ở nhóm `(1)`
`+` Xuất hiện kết tủa màu trắng `-> Na_2SO_4`
`PT: Na_2SO_4 + BaCl_2 -> 2NaCl + BaSO_4`
`+` Mẫu thử còn lại `-> BaCl_2`.
Câu 1:
- Trích mẫu thử
- Cho quỳ tím vào các mẫu thử
+ Quỳ tím hóa đỏ: \(H_2SO_4\)
+ Quỳ tím hóa xanh: \(Ba\left(OH\right)_2,NaOH\)
- Cho \(ddH_2SO_{\text{4}}\) đã nhận biết vào 2 mẫu thử chưa nhận biết
+ Xuất hiện kết tủa trắng: \(Ba\left(OH\right)_2\)
\(PTHH:Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+\downarrow2H_2O\)
+ Không hiện tượng: \(NaOH\)
\(PTHH:2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
đánh dấu và lấy mẫu thử
cho dd Ba(OH)2 vào dd
+ nếu có kết tủa => H2SO4
pthh Ba(OH)2 + H2SO4--> BaSO4 + 2H2O
+ Nếu không có hiện tượng => Ba(OH),NaOH
- cho H2SO4 vào 2 dd
+ nếu có kết tủa => Ba(OH)2 pthh như ở trên
+ nếu ko có hiện tượng => NaOH
pthh 2NaOH+ H2SO4-- > Na2SO4 + 2H2O