Cho \(x\left(g\right)Mg\) phản ứng với dd \(HNO_3\) dư thu được 4,48 lít khí \(X\) gồm \(NO\) và \(NO_2\) có tỉ khối so với \(H_2\) là 19. Tìm giá trị của \(x\)
Giúp mình vssss!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
NO: x mol
CO2: y mol
x+y=0,2
30x+44y=0,2.37
=>x=0,1 mol; y=0,1 mol
=>nMgCO3=nCO2=0,1 mol
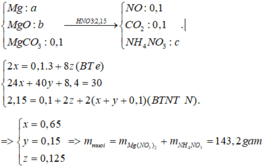
Chú ý:
Phản ứng tạo muối NH4NO3.

Đáp án : B
Khi X + CO dư -> Fe
=> mO pứ + mFe = mX => nO pứ = 0,13 mol
Qui hỗn hợp X về : 0,17 mol Fe và 0,13 mol O
Vì MY = ½ (MNO + MNO2) => nNO = nNO2 = x mol
Bảo toàn e : 3nFe = 3nNO + nNO2 + 2nO
=> 3.0,17 = 3x + x + 0,13.2 => x = 0,0625 mol
=>VY = 22,4.(0,0625 + 0,0625) = 2,8 lit
\(n_X=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(M_X=19.2=38\left(g\text{/}mol\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{V_{NO}}{V_{NO_2}}=\dfrac{n_{NO}}{n_{NO_2}}=\dfrac{46-38}{38-30}=\dfrac{1}{1}\\ \rightarrow n_{NO}=n_{NO_2}=\dfrac{1}{2}n_X=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
Gọi \(n_{Mg}=a\left(mol\right)\left(đk:a>0\right)\)
Quá trình nhận, nhường electron:
\(N^{+5}+3e\rightarrow N^{+2}\)
0,1--->0,3
\(N^{+5}+1e\rightarrow N^{+4}\)
0,1--->0,1
\(Mg^0-2e\rightarrow Mg^{+2}\)
a---->2a
\(\rightarrow BTe:2a=0,1+0,3\\ \Leftrightarrow a=0,2\left(mol\right)\left(TM\right)\\ \rightarrow x=m_{Mg}=0,2.24=4,8\left(g\right)\)