đốt cháy 2,17g photpho trong bình chứa 1,512l khí oxi(đktc),sau pư thu được chất rắn A.Chia A thành 2 phần bằng nhau: 1)Phần 1 hòa tan vào 250g nước thì thu được đ có nồng độ cồn bằng bao nhiêu phần trăm 2)Lấy phần 2 hòa tan vào bao nhiêu gam nước để có đ axit 10%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
4P + 5O2 \(\underrightarrow{t^o}\) 2P2O5
\(\dfrac{0,1}{4}< \dfrac{0,2}{5}\) => O2 dư, Photpho đủ
\(n_{O_2}=0,2-0,04=0,16\left(mol\right)\)
\(m_{P_2O_5}=\) 0,05 . 142 = 7,1 ( g )

a) \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: 0,1 0,075 0,05
\(V_{O_2}=0,075.22,4=1,68\left(l\right)\)
b) \(m_{Al_2O_3}=0,05.102=5,1\left(g\right)\)
c)
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Mol: 0,05 0,3 0,1
\(m_{ddHCl}=\dfrac{0,3.36,5.100}{7,3}=150\left(g\right)\)

Ta có: m1 = m2 = 11,05 (g)
Phần 1:
PT: \(2Zn+O_2\underrightarrow{t^o}2ZnO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
Theo ĐLBT KL, có: mKL + mO2 = m oxit
⇒ mO2 = 18,25 - 11,05 = 7,2 (g)
\(\Rightarrow n_{O_2}=\dfrac{7,2}{32}=0,225\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Zn}+\dfrac{3}{4}n_{Al}+\dfrac{1}{2}n_{Mg}=0,225\left(mol\right)\)
\(\Rightarrow n_{Zn}+\dfrac{3}{2}n_{Al}+n_{Mg}=0,45\left(1\right)\)
Phần 2:
PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}+n_{Mg}\left(2\right)\)
Từ (1) và (2) \(\Rightarrow n_{H_2}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
Theo PT: \(n_{H_2SO_4}=n_{H_2}=0,45\left(mol\right)\)
Theo ĐLBT KL, có: mKL + mH2SO4 = m muối + mH2
⇒ m chất rắn khan = m muối = 11,05 + 0,45.98 - 0,45.2 = 54,25 (g)
Bạn tham khảo nhé!

\(a) n_{O_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ n_{Fe} = \dfrac{3}{2}n_{O_2} = 0,15(mol)\\ m_{Fe} = 0,15.56 = 8,4(gam)\\ b) \%Fe = \dfrac{56.3}{56.3+16.4}.100\% = 72,41\% \%O = 100\% - 72,41\% = 27,59\%\\ c) 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,2(mol)\\ m_{KMnO_4} = 0,2.158 = 31,6(gam)\)
\(n_{O_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(0.15.......0.1......0.05\)
\(m_{Fe_3O_4}=0.05\cdot232=11.6\left(g\right)\)
\(\%Fe=\dfrac{0.05\cdot3\cdot56}{11.6}\cdot100\%=72.41\%\)
\(\%O=10072.41=27.59\%\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.2...................................................0.1\)
\(m_{_{ }KMnO_4}=0.2\cdot158=31.6\left(g\right)\)
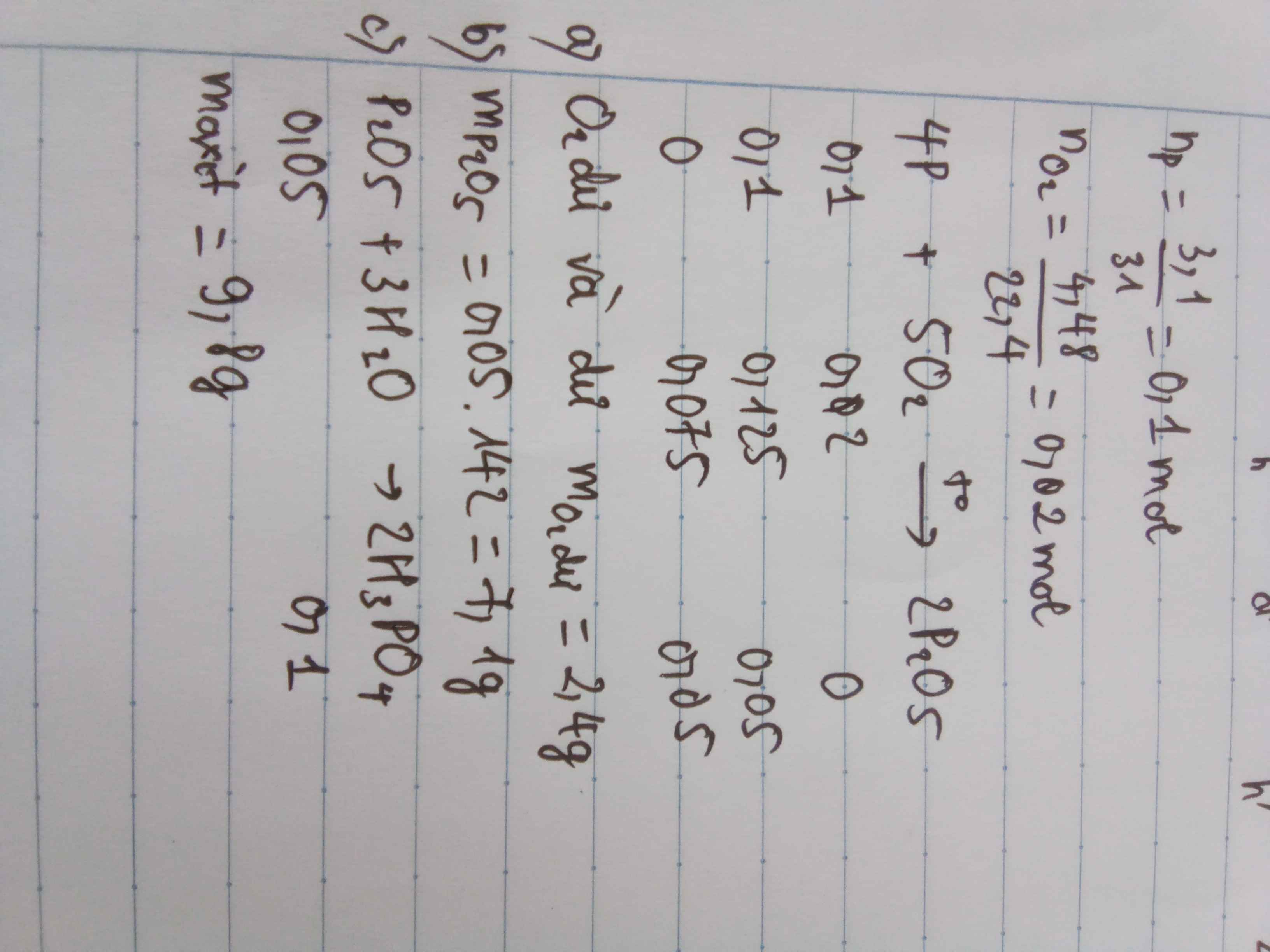
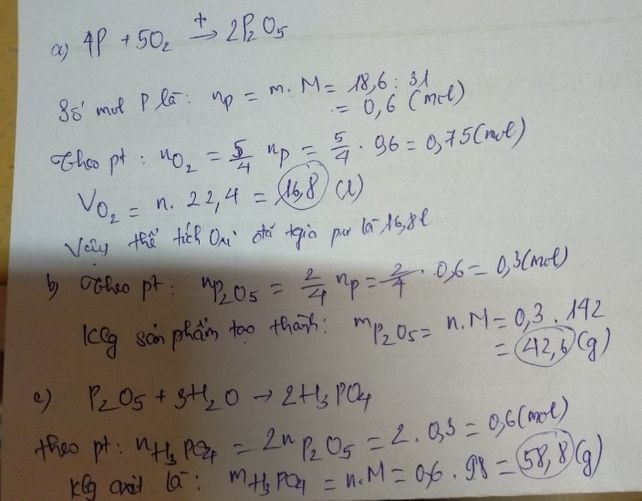
 Bạn tham khảo cách làm nhé! cho mik 1 like nha
Bạn tham khảo cách làm nhé! cho mik 1 like nha




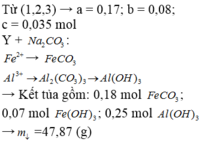
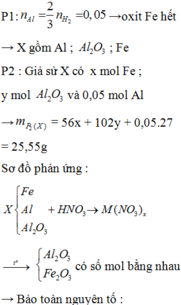
MƠN BẠN NHA!!!