Một hỗn hợp A gồm CH4 , H2 , CO Thí nghiệm 1: Nếu đốt cháy 8,96lít hỗn hợp A cần dùng 7,84 lít O2 Thí nghiệm 2 : Nếu dẫn 14,8g hỗn hợp qua ống đựng CuO dư nung nóng thì có 48g CuO đã phản ứng Tính % thể tích mỗi chất trong hỗn hợp A biết các khí đo ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


chộ cái mặt nhà mi là biết rồi , vào trang chủ của tau rồi bấm theo dõi đi

CO+1/2O2------>CO2
x-----1/2x ----------x mol
H2 + CuO --------> Cu +H2O
0,3<--------------------0,3
=>y=0,3
ta có CO2 + Ca(OH)2 -->CaCO3 +H2O
0,2<-------------------- 0,2
=> x=0,2 mol
tỉ lệ về số mol cũng là tỉ lệ thể tích
%VCO=(0,2/0,5).100%=40% , %VH2=60%.

Đáp án B
Số thí nghiệm có thể xảy ra phản ứng oxi hóa kim loại là : (1), (3), (4), (5)

Đáp án:
→%mFe2O3=66,67%;%mCuO=33,33%→%mFe2O3=66,67%;%mCuO=33,33%
Giải thích các bước giải:
Gọi số mol 2 oxit lần lượt là x, y.
→160x+80y=24 gam→160x+80y=24 gam
Phản ứng xảy ra:
Fe2O3+3CO→2Fe+3CO2Fe2O3+3CO→2Fe+3CO2
CuO+COto→Cu+CO2CuO+CO→toCu+CO2
Khối lượng rắn giảm là do O bị khử
→nO bị khử=3nFe2O3 phản ứng+nCuO phản ứng=3x.80%+y.80%=24−18,8816=0,32 mol→nO bị khử=3nFe2O3 phản ứng+nCuO phản ứng=3x.80%+y.80%=24−18,8816=0,32 mol
Giải được: x=y=0,1.
→%mFe2O3=160x24=66,67%→%mCuO=33,33%

a Z n + C u S O 4 → Z n S O 4 + C u Z n + H 2 S O 4 → Z n S O 4 + H 2
(Zn tác dụng với C u S O 4 trước, với H 2 S O 4 (loãng) sau do tính oxi hóa C u 2 + > H + ).
b F e N O 3 2 + A g N O 3 → F e N O 3 3 + A g c C u O + H 2 → t ° C u + H 2 O A l 2 O 3 + H 2 → k h ô n g p h ả n ứ n g d 2 N a + 2 H 2 O → 2 N a O H + H 2 C u S O 4 + 2 N a O H → C u O H 2 + N a 2 S O 4
(Na tác dụng với H 2 O trước, Na không khử được ion C u 2 + trong dung dịch).
e 2 A g N O 3 → t ° 2 A g + 2 N O 2 + O 2 2 K N O 3 → t ° 2 K N O 2 + O 2
→ Có 4 thí nghiệm sau phản ứng thu được kim loại
→ Đáp án C

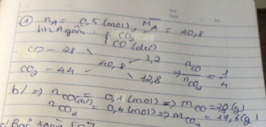

\(n_{CH_4} = a(mol) ; n_{H_2} = b(mol) ; n_{CO} = c(mol)\\ \Rightarrow a + b + c = \dfrac{8,96}{22,4} = 0,4(1)\\ TN1 :\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ 2CO + O_2 \xrightarrow{t^o} 2CO_2\\ n_{O_2} = 2a + 0,5b + 0,5c = \dfrac{7,84}{22,4} = 0,35(2)\\ TN2:\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ \)
\(n_{CuO} = \dfrac{48}{80} = 0,6(mol) CuO + CO \xrightarrow{t^o} Cu + CO_2\\ \dfrac{m_{hh}}{n_{CuO}}=\dfrac{16a + 2b + 28c}{b + c} = \dfrac{14,8}{0,6}(3)\\ (1)(2)(3) \Rightarrow a = 0,1 ; b = 0,1 ; c = 0,2\\ \%V_{CH_4} = \%V_{H_2} = \dfrac{0,1}{0,4}.100\% = 25\%\\ \%V_{CO} = \dfrac{0,2}{0,4}.100\% = 50\%\)