Cho V lít khí hidro dư(đktc) tác dụng hoàn toàn với 53,2 gam hỗn hợp CuO và Fe2O3,ZnO thu được 14,4 gam nước và m gam chất rắn B.
a) Viết phương trình phản ứng
b) Tính V
c) Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left[O\right]_{KL}+H_2->H_2O\\ n_{H_2O}=n_{H_2}=\dfrac{14,4}{18}=0,8mol\\ v=0,8.22,4=17,92L\\ m_{KL}=m=47,2-16.0,8=34,4g\)

Gọi a (mol) và b (mol) lần lượt là số mol của CuO và Fe2O3.
Ta có: 80a+160b=40 (1).
160b:80a=1:2 \(\Rightarrow\) a-4b=0 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra a=1/3 (mol) và b=1/12 (mol).
Khối lượng chất rắn thu được là 1/3.64+1/12.2.56=92/3 (g).
Số mol khí hiđro thu được bằng số mol sắt trong X và bằng 1/12.2=1/6 (mol). V=1/6.22,4=56/15 (lít).

Đáp án C
Ta có nO bị lấy đi bởi CO = 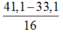 = 0,5 mol
= 0,5 mol
⇒ nCO pứ = nO = 0,5 mol
Bảo toàn e cả quá trình ta có: 2nCO = 2nH2 Û nH2 = nCO = 0,5 mol
⇒ VH2 = 0,5 × 22,4 = 11,2 lít
a, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(ZnO+H_2\underrightarrow{t^o}Zn+H_2O\)
b, Ta có: \(n_{H_2O}=\dfrac{14,4}{18}=0,8\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{H_2O}=0,8\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,8.22,4=17,92\left(l\right)\)
c, Theo ĐLBT KL, có: m oxit + mH2 = m chất rắn + mH2O
⇒ m = 53,2 + 0,8.2 - 14,4 = 40,4 (g)
Bạn tham khảo nhé!