a) Cho 12 gam hỗn hợp hai kim loại Cu, Fe (tỉ lệ mol tương ứng là 1:1) tan hoàn toàn trong H2SO4 đặc, nóng, dư thu được V lít SO2 (sản phẩm khử duy nhất, đktc). Tính giá trị của V.
b) Cho 4,5 gam một kim loại R tan hoàn toàn trong H2SO4 đặc nóng dư thu được 2,24 lít hỗn hợp hai khí SO2 và H2S (đktc) có tỉ khối so với H2 là 24,5 và dung dịch X. Tìm kim loại R và khối lượng muối tạo thành trong dung dịch sau phản ứng


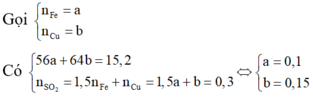


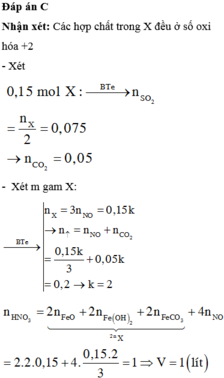
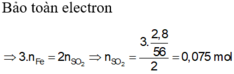

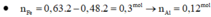
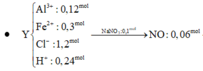
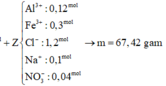




a) Gọi nCu = a (mol) => nFe = a (mol)
=> 64a + 56a = 12
=> a = 0,1 (mol)
PTHH:
Cu + 2H2SO4 (đặc, nóng) ---> CuSO4 + SO2 + 2H2O
0,1------------------------------------------->0,1
2Fe + 6H2SO4 (đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,1--------------------------------------------------->0,3
=> VSO2 = (0,3 + 0,1).22,4 = 8,96 (l)
b) \(n_{hh}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(M_{hh}=24,5.2=49\left(\dfrac{g}{mol}\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{SO_2}}{n_{H_2S}}=\dfrac{V_{SO_2}}{V_{H_2S}}=\dfrac{64-49}{49-34}=\dfrac{1}{1}\)
\(\rightarrow n_{SO_2}=n_{H_2S}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
PTHH:
2R + 2nH2SO4 (đặc, nóng) ---> R2(SO4)n + nSO2 + 2nH2O
\(\dfrac{0,1}{n}\)<------------------------------------------------0,05
8R + 5nH2SO4 (đặc, nóng) ---> 4R2(SO4)n + nH2S + 4nH2O
\(\dfrac{0,4}{n}\)<-------------------------------------------------0,05
\(\rightarrow n_R=\dfrac{0,1}{n}+\dfrac{0,4}{n}=\dfrac{0,5}{n}\left(mol\right)\\ \rightarrow M_R=\dfrac{4,5}{\dfrac{0,5}{n}}=9n\left(\dfrac{g}{mol}\right)\)
Xét n = 3 thoả mãn => MR = 27 (g/mol)
Vậy R là Al