Cho 4,6g natri tác dụng hết với nước
1. Tính thể tíc khí hdro thoát ra(đktc)
2. Dung dịch sau phản ứng làm giấy quỳ tím chuyển sang màu gì
mn giúp em vứi:C
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,3 0,15
\(n_{Na}=\dfrac{6,9}{23}=0,3\left(mol\right)\)
\(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
0,1 0,05
\(n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\)
\(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
Dung dịch sau p/u biến đổi quỳ tím thành màu xanh vì dd có tính bazo

\(a,2Na+2H_2O\rightarrow2NaOH+H_2\\ 2K+2H_2O\rightarrow2KOH+H_2\\ b,n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right);n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\\ n_{H_2}=\dfrac{1}{2}.\left(0,2+0,1\right)=0,15\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\\ c,Dung.dịch.sau.phản.ứng.có.KOH.và.NaOH.đều.là.kiềm.\\ \Rightarrow Quỳ.tím.hoá.xanh\)
\(n_{Na}=\dfrac{m}{M}=\dfrac{4,6}{23}=0,2mol\)
\(n_K=\dfrac{m}{M}=\dfrac{3,9}{39}=0,1mol\)
\(Na+2H_2O\rightarrow Na\left(OH\right)_2+H_2\)
\(K+2H_2O\rightarrow K\left(OH\right)_2+H_2\)
\(V_{H_2}=n_{H_2}.22,4=\left(0,2+0,1\right).22,4=6,72l\)
Dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh

Dung dịch sau phản ứng làm biến đổi giấ quỳ hóa xanh vì sau phản ứng thu được dung dịch bazo ( NaOH, KOH).

a) 2Na+2H2O→2NaOH+H2(1)
2K+2H2O→2KOH+H2(2)
b) nNa=\(\dfrac{4,6}{23}\)=0,2(mol)
Theo PTHH (1): nNa:nH2=2:1
⇒nH2(1)=nNa.12=0,2.12=0,1(mol)
⇒VH2(1)=0,1.22,4=2,24(l)
nK=\(\dfrac{3,9}{39}\)=0,1(mol)
Theo PTHH (2): nK:nH2=2:1
⇒nH2(2)=nK.12=0,1.12=0,05(mol)
⇒VH2(2)=0,05.22,4=1,12(l)
⇒Vh2=2,24+1,12=3,36(l)
c) Dung dịch thu được sau phản ứng làm giấy quỳ tím chuyển đổi thành màu xanh vì nó là dung dịch bazơ.
d)
Fe2O3+3H2-to>2Fe+3H2O
0,15------0,1
n Fe2O3=0,1 mol
=>Fe2O3 dư
=>m Fe=0,1.56=5,6g

\(n_{Al}=\dfrac{10,8}{27}=0,4mol\)
\(n_{HCl}=\dfrac{49}{36,5}=1,34mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Xét: \(\dfrac{0,4}{2}\) < \(\dfrac{1,34}{6}\) ( mol )
0,4 1,2 0,4 0,6 ( mol )
\(V_{H_2}=0,6.22,4=13,44l\)
\(m_{AlCl_3}=0,4.133,5=53,4g\)
\(m_{HCl\left(dư\right)}=\left(1,34-1,2\right).36,5=5,11g\)
Nhúng quỳ tím vào dung dịch sau phản ứng thấy quỳ tím hóa đỏ, vì sau phản ứng dd HCl còn dư.

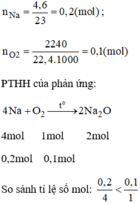
Vậy O 2 dư.
Sau phản ứng Na không dư nên không có khí H 2 bay ra, quỳ tím chuyển sang màu xanh vì:
N a 2 O + H 2 O → 2 N a O H

a)
$n_{HCl} = 0,2.2 = 0,4(mol)$
$n_{Zn} = \dfrac{9,75}{65}= 0,15(mol)$
$Zn + 2HCl \to ZnCl_2 + H_2$
Ta thấy :
n Zn / 1 = 0,15 < n HCl / 2 = 0,2 nên HCl dư
n H2 = n Zn = 0,15(mol)
V H2 = 0,15.22,4 = 3,36 lít
b)
n HCl pư = 2n Zn = 0,3(mol)
=> n HCl dư = 0,4 - 0,3 = 0,1(mol)
n ZnCl2 = n Zn = 0,15(mol)
CM HCl = 0,1/0,2 = 0,5M
CM ZnCl2 = 0,15/0,2 = 0,75M
c)
Dung dịch A làm quỳ tím hóa đỏ vì có HCl dư
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\\n_{HCl}=0,2\cdot2=0,4\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,4}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{ZnCl_2}=n_{H_2}=0,15\left(mol\right)\\n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\\C_{M_{ZnCl_2}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\\C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\end{matrix}\right.\)
Vì HCl còn dư, nên dd sau p/ứ làm quỳ tím hóa đỏ
nNa = 4,6 : 23 = 0,2 (mol)
pthh: 2Na + 2H2O →2NaOH + H2
0,2 0,1 (mol)
=> VH2 = 0,1 . 22,4 = 2,24 L
dung dịch sau pư làm QT chuyển xanh