cho 5.4 g al vào dung dịch h2so4 loãng có chứa 39 ,2 g
a) chất nào còn dư sau phản ứng ? bao nhiêu gam ?
b) tính thể tích khí hidro thu được ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAl=0.2(mol)
nH2SO4=0.4(mol)
2Al+3H2SO4->Al2(SO4)3+3H2
Theo pthh,nH2SO4=3/2 nAl
Theo bài ra,nH2SO4=2nAl
-> H2SO4 dư tính theo Al
nH2SO4 phản ứng:0.2*3/2=0.3(mol)
nH2SO4 dư=0.40.3=0.1(mol)
mH2SO4 dư:0.1*98=9.8(g)
Theo pthh,nH2=3/2 nAl->nH2=0.3(mol)
VH2=0.3*22.4=6.72(l)

nFe = 22.4/56 = 0.4 (mol)
nH2SO4 = 24.5/98 = 0.25 (mol)
Fe + H2SO4 => FeSO4 + H2
0.25.....0.25.....................0.25
mFe(dư) = ( 0.4 - 0.25 ) * 56 = 8.4 (g)
VH2 = 0.25 * 22.4 = 5.6 (l)
nFe=\(\dfrac{22,4}{56}\)= 0,4 ( mol)
nH2SO4=\(\dfrac{24,5}{98}\)=0,25 ( mol )
Fe + H2SO4 → FeSO4 + H2
Trước phản ứng: 0,4 0,25 ( mol )
Phản ứng: 0,25 0,25 0,25 ( mol )
Sau phản ứng: 0,15 0,25 0,25 ( mol )
a) m= n.M= 0,15.56=8,4 (g)
vậy Fe còn dư và dư 8,4 gam
b) VH2= n.22,4= 0,25.22,4=5,6 (l)

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{Fe\left(p.ứ\right)}=n_{H_2SO_4}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(g\right)\\ m_{Fe\left(dư\right)}=0,14.56=8,4\left(g\right)\)

nFe=11,2/56=0,2 mol
nH2SO4=24,5/98=0,25
PTPƯ: Fe + H2SO4 ---> FeSO4 + H2
0,2 mol ----> 0,2 mol --------------------> 0,2 mol
Ta có Fe:H2SO4=0,2/1<0,25/1 (nên H2SO4 dư)
a, mH2SO4=(0,25-0,2).98=4,9 g
b, VH2=0,2.22,4=4,48 l

PTHH: \(Fe+H_2SO_{4\left(l\right)}\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Sắt còn dư, Axit p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,25\left(mol\right)\\n_{Fe\left(dư\right)}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,25\cdot22,4=5,6\left(l\right)\\m_{Fe\left(dư\right)}=0,15\cdot56=8,4\left(g\right)\end{matrix}\right.\)

\( n_{Al}=\dfrac{2,7}{27}=0,1mol\)
\(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,25 0 0
0,1 0,15 0,05 0,15
0 0,1 0,05 0,15
Chất \(H_2SO_4\) dư và dư \(m=0,1\cdot98=9,8g\)
\(V_{H_2}=0,15\cdot22,4=3,36l\)
\(nAl=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(nH_2SO_4=\dfrac{24,5}{98}=0,25\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,1---->0,15------>0,05--------------->0,15
Xét tỉ lệ : \(\dfrac{0,1}{2}< \dfrac{0,25}{3}\)
=> H2SO4 dư vs pứ
\(nH_2SO_{4\left(dư\right)}=0,25-0,15=0,1\left(mol\right)\)
\(mH_2SO_4=\)\(0,1.98=9,8\left(g\right)\)
\(VH_2=0,15.22,4=3,36\left(lít\right)\)

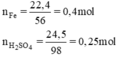
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 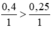 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2mol\)
\(n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{29,2}{36,5}=0,8mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 < 0,8 ( mol )
0,2 0,6 0,3 ( mol )
Chất còn dư là HCl
\(m_{HCl\left(du\right)}=n_{HCl\left(du\right)}.M_{HCl\left(du\right)}=\left(0,8-0,6\right).36,5=7,3g\)
\(V_{H_2}=n_{H_2}.22,4=0,3.22,4=6,72l\)
nAl=0.2(mol)
nH2SO4=0.4(mol)
2Al+3H2SO4->Al2(SO4)3+3H2
Theo pthh,nH2SO4=3/2 nAl
Theo bài ra,nH2SO4=2nAl
-> H2SO4 dư tính theo Al
nH2SO4 phản ứng:0.2*3/2=0.3(mol)
nH2SO4 dư=0.40.3=0.1(mol)
mH2SO4 dư:0.1*98=9.8(g)
Theo pthh,nH2=3/2 nAl->nH2=0.3(mol)
VH2=0.3*22.4=6.72(l)