cho 32 gam hỗn hợp mg và kim loại R chia thành hai phần bằng nhau phần 1: tác dụng với HCl dư thu được 8,96 lít H2 phần 2: cho tác dụng với h2so4 đặc thu được 11,2 lít S02. xác định R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Các PTHH :
2Al + 3 H 2 SO 4 → Al 2 SO 4 3 + 3 H 2 (1)
2Al + 6 H 2 SO 4 → Al 2 SO 4 3 + 3 SO 2 + 6 H 2 O (2)
Cu + 2 H 2 SO 4 → Cu SO 4 + 2 H 2 O + SO 2 (3)
Theo PTHH (1) số mol Al tham gia phản ứng bằng 2/3 số mol H 2 => Khối lượng AI trong hỗn hợp : 2×2/3×0,06×27 = 2,16(g)
Số mol SO 2 được giải phóng bởi Al: 2,16/27 x 3/2 = 0,12 mol
Theo PTHH (2) và (3) số mol SO 2 giải phóng bởi Cu : 2.0,1 - 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08. 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).

\(n_{H_2}=n_O=0,25\left(mol\right)\\\dfrac{a}{2}=11,15-0,25.16\\ =>a=14,3\left(g\right)\)

P1 :\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: nH2 = nFe = 0,1 mol
P2 :2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O (1)
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (2)
Ta có: \(\dfrac{3}{2}.0,1\) + nSO2(2) = 0,4 mol
=> x = 0,1 ; y = 0,25 mol
Do chia 2 hỗn hợp X thành phần bằng nhau nên trong gam X có: 0,2 mol Fe và 0,5 mol Cu
=> \(\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,3.64}.100=36,84\%\)
%m Cu=63,16%

- Xét phần 1: Khi hòa tan phần 1 vào nước dư thu được \(\dfrac{3,584}{22,4}=0,16\) mol H2
- Xét phần 2:
\(n_{Ca}=\dfrac{5,9}{40}=0,1475\left(mol\right)\)
PTHH: Ca + 2H2O --> Ca(OH)2 + H2
=> Khi hòa tan phần 2 vào NaOH dư thu được \(\dfrac{8,232}{22,4}-0,1475=0,22\) mol H2 và dd Z
=> M tan được trong nước, R tan được trong dd kiềm
Gọi số mol của M, R trong mỗi phần là a, b
=> a.MM + b.MR = 12,3 (g)
* Xét phần 2:
- Nếu M không phải là Ca
\(\%Ca=\dfrac{5,9}{12,3+5,9}.100\%=32,418\%< 50\%\)
=> vô lí
=> M là Ca
Giả sử R có hóa trị n
\(m_{Ca\left(Y\right)}=\dfrac{\left(12,3+5,9\right).50}{100}=9,1\left(g\right)\)
=> \(n_{Ca\left(Y\right)}=\dfrac{9,1}{40}=0,2275\left(mol\right)\)
\(m_{R\left(Y\right)}=\left(12,3+5,9\right)-9,1=9,1\left(g\right)\)
PTHH: Ca + 2H2O --> Ca(OH)2 + H2
0,2275------------------->0,2275
R + (4-n)NaOH + (n-2)H2O --> Na4-n(RO2) + \(\dfrac{n}{2}\)H2
\(\dfrac{0,28}{n}\)<--------------------------------------------0,14
=> \(M_R=\dfrac{9,1}{\dfrac{0,28}{n}}=32,5n\left(g/mol\right)\)
Xét n = 1 => Loại
Xét n = 2 => MR = 65(g/mol) => R là Zn
Xét n = 3 => Loại
Vậy M là Ca, R là Zn

Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.

Đáp án : A
P1 : ne trao đổi = nNO2 = 0,47 mol
P2 : ne trao đổi = nCl2 .2 => nCl2 pứ = 0,235 mol
=> mKL = mmuối – mCl2 pứ = 11,19g
=> m = 2.11,19 = 22,38g

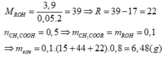
Gọi số mol Mg, R trong mỗi phần là a, b (mol)
=> 24a + b.MR = 16 (1)
* Nếu R tan trong HCl
- Phần 1:
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
a-------------------->a
2R + 2nHCl --> 2RCln + nH2
b--------------------->0,5bn
=> a + 0,5bn = 0,4 (2)
-Phần 2: \(n_{SO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Mg + 2H2SO4 --> MgSO4 + SO2 + 2H2O
a-------------------------->a
2R + 2mH2SO4 --> R2(SO4)m + mSO2 + 2mH2O
b----------------------------->0,5bm
=> a + 0,5bm = 0,5 (3)
(3) - (2) => 0,5bm - 0,5bn = 0,1 (mol)
=> bm - bn = 0,2 => m > n
- Xét n = 1; m = 2 => b = 0,2 (mol) => a = 0,3 (mol)
(1) => MR = 44 (g/mol) => Loại
- Xét n = 1; m = 3 => b = 0,1 (mol) => a = 0,35 (mol)
(1) => MR = 76 (g/mol) => Loại
- Xét n = 2; m = 3 => b = 0,2 (mol) => a = 0,2 (mol)
(1) => MR = 56 (g/mol) => R là Fe
* Nếu R không tan trong HCl
- Phần 1:
PTHH: Mg + 2HCl --> MgCl2 + H2
0,4<--------------------0,4
=> a = 0,4 (mol)
- Phần 2:
PTHH: Mg + 2H2SO4 --> MgSO4 + SO2 + 2H2O
0,4-------------------------->0,4
2R + 2kH2SO4 --> R2(SO4)k + kSO2 + 2kH2O
\(\dfrac{0,2}{k}\)<--------------------------0,1
Có: \(m_{R\left(phần.2\right)}=16-0,4.24=6,4\left(g\right)\)
=> \(M_R=\dfrac{6,4}{\dfrac{0,2}{k}}=32k\left(g/mol\right)\)
Xét k = 2 thỏa mãn => MR = 64 (g/mol) => R là Cu