cho 9,4 gam hỗn hợp Na và kim loại R hoá trị ii tan trong nước dư thoát ra 3,36lít H2. Mặt khác cho 0,2 mol hỗn hợp kim loại trên tác dụng với HCl dư sinh ra 3,36lit H2. Xác định R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Lần cuối cùng nhé bạn, đừng để hành động của mình mà phá vỡ những gì đã cố gắng.

Sửa đề 22,4 l => 4,48 l
\(n_{H_2\left(1\right)}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_{H_2\left(2\right)}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ m_Y=m_R\)
PTHH: Ca + 2H2O ---> Ca(OH)2 + H2
0,2<------------------------------0,2
R + 2HCl ---> RCl2 + H2
0,2<------------------------0,2
\(\rightarrow M_R=\dfrac{13,6-0,2.40}{0,2}=24\left(\dfrac{g}{mol}\right)\)
=> R là Mg (t/m)

Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn

Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

2Na+2H2O->2NaOH+H2
x-------------------x----------0,5x mol
Ba+2H2O->Ba(OH)2+H2
y---------------------y----------y mol
aTa có :)\(\left\{{}\begin{matrix}23x+137y=2,06\\0,5x+y=0,025\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}x=0,03\\y=0,01\end{matrix}\right.\)
=>mbazo=0,03.40+0,01.171=2,91g
=>m Na=0,03.23=0,69g
=>m Ba=0,01.137=1,27g

Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
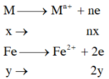
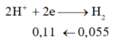
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
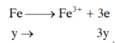
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C

1.
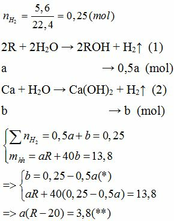
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
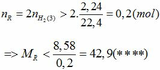
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
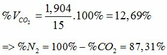
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
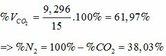

Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_xO_y}=a\left(mol\right)\end{matrix}\right.\)
=> 80a + 56ax + 16ay = 2,4 (1)
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
FexOy + yH2 --to--> xFe + yH2O
a---------------->ax
Fe + 2HCl --> FeCl2 + H2
ax--------------------->ax
=> \(ax=0,02\left(mol\right)\)
=> a = \(\dfrac{0,02}{x}\)
Thay vào (1)
\(80.\dfrac{0,02}{x}+56.0,02+\dfrac{16.0,02y}{x}=2,4\)
=> \(\dfrac{1,6}{x}+\dfrac{0,32y}{x}=1,28\)
=> 1,28x = 0,32y + 1,6
Chọn x = 2; y = 3 thỏa mãn
=> CTHH: Fe2O3


TN1: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_R=b\left(mol\right)\end{matrix}\right.\)
PTHH:
2Na + 2H2O ---> 2NaOH + H2
a--------------------------------->0,5a
R + 2H2O ---> R(OH)2 + H2
b------------------------------>b
=> 0,5a + b =0,15 (1)
TN2: \(\left\{{}\begin{matrix}n_{Na}=ak\left(mol\right)\\n_R=bk\left(mol\right)\end{matrix}\right.\)
=> ak + bk = 0,2 (2)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH:
2Na + 2HCl ---> 2NaCl + H2
ak------------------------------>0,5ak
R + 2HCl ---> RCl2 + H2
bk------------------------>bk
=> 0,5ak + bk = 0,15 (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\\k=1\end{matrix}\right.\)
\(\rightarrow M_R=\dfrac{9,4-0,1.23}{0,1}=71\left(\dfrac{g}{mol}\right)\) Đề sai à bạn?
mình giải ra thấy sai nên vào hỏi mọi người thử á