Bài 24: Đốt 6,5 gam Kẽm trong khí oxi ở đktc
a/ Tính thể tích khí oxi cần dùng?
b/ Tính khối lượng sản phẩm thu được?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = 11,2 : 56 = 0,2 (mol)
pthh : 3Fe + 2O2 -t-> Fe3O4
0,2 0,13 0,06
=> VO2 = 0,13 . 22,4 = 2,912 l
=> mFe3O4 = 0,06 . 232 = 13,93g
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,2 2/15 1/15 ( mol )
\(V_{O_2}=\dfrac{2}{15}.22,4=2,98l\)
\(m_{Fe_3O_4}=\dfrac{1}{15}.232=15,46g\)

2Mg+O2-to>2MgO
0,1-----0,05-----0,1
n Mg=\(\dfrac{2,4}{24}\)=0,1 mol
=>VO2=0,05.22,4=1,12l
=>m MgO=0,1.40=4g
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
pthh : 2Mg + O2 -t-> 2MgO
0,1 0,05 0,1
=> VO2 = 0,05 . 22,4 = 1,12 (l)
=> mMgO = 0,1 .40 = 4 (g)

3Fe+2O2-to>Fe3O4
0,75---0,5--------0,25
n O2=0,5 mol
=>m Fe=0,75.56=42g
=>m Fe3O4=0,25.232=58g
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,75 0,5 0,25 ( mol )
\(m_{Fe}=0,75.56=42g\)
\(m_{Fe_3O_4}=0,25.232=58g\)

$a\big)$
$n_{Fe}=\frac{16,8}{56}=0,3(mol)$
$3Fe+2O_2\xrightarrow{t^o}Fe_3O_4$
Theo PT: $n_{Fe_3O_4}=\frac{1}{3}n_{Fe}=0,1(mol)$
$\to m_{Fe_3O_4}=0,1.232=23,2(g)$
$b\big)$
Theo PT: $n_{O_2}=\frac{2}{3}n_{Fe}=0,2(mol)$
$\to V_{O_2}=0,2.22,4=4,48(l)$
$\to V_{kk}=4,48.5=22,4(l)$
$c\big)$
$2KMnO_4\xrightarrow{t^o}K_2MnO_4+MnO_2+O_2$
Theo PT: $n_{KMnO_4}=2n_{O_2}=0,4(mol)$
$\to m_{KMnO_4(dùng)}=\frac{0,4.158}{80\%}=79(g)$
a, \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH: 3Fe + 2O2 ---to→ Fe3O4
Mol: 0,3 0,2 0,1
\(m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
b, \(V_{O_2}=0,2.22,4=4,48\left(l\right)\Rightarrow V_{kk}=4,48.5=22,4\left(l\right)\)
c,
PTHH: 2KMnO4 ---to→ K2MnO4 + MnO2 + O2
Mol: 0,4 0,2
\(m_{KMnO_4\left(lt\right)}=0,4.158=63,2\left(g\right)\)
\(\Rightarrow m_{KMnO_4\left(tt\right)}=\dfrac{63,2}{80\%}=79\left(g\right)\)

a) nFe = 16,8/56 = 0,3 (mol)
PTHH: 3Fe + 2O2 -> (t°) Fe3O4
Mol: 0,3 ---> 0,2 ---> 0,1
mFe3O4 = 0,1 . 232 = 23,2 (g)
b) VO2 = 0,2 . 22,4 = 4,48 (l)
Vkk = 4,48 . 5 = 22,4 (l)
c) H = 100% - 20% = 80%
nO2 (LT) = 0,2 : 80% = 0,25 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,25 . 2 = 0,5 (mol)
mKMnO4 = 0,5 . 158 = 79 (g)

a. \(n_{Fe}=\dfrac{1,8.10^{23}}{6.10^{23}}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{6.72}{22,4}=0,3\left(mol\right)\)
PTHH : 3Fe + 2O2 -> Fe3O4
0,3 0,2 0,1
Ta thấy : \(\dfrac{0.3}{3}< \dfrac{0.3}{2}\) => Fe đủ , O2 dư
\(m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
b. \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
\(V_{kk}=4,48.5=22,4\left(l\right)\)
a)\(n_{Fe}=\dfrac{1,8\cdot10^{23}}{6\cdot10^{23}}=0,3mol\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,3 0,3 0
0,3 0,2 0,1
0 0,1 0,1
\(m_{Fe_3O_4}=0,1\cdot232=23,2g\)
b)\(V_{O_2}=0,1\cdot22,4=2,24l\)
\(\Rightarrow V_{kk}=5V_{O_2}=5\cdot2,24=11,2l\)

a.b.
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe_3O_4}=0,1.232=23,2g\)
\(V_{O_2}=0,2.22,4=4,48l\)
\(V_{kk}=4,48.5=22,4l\)
c.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(m_{KMnO_4}=\dfrac{0,4.158}{\left(100-20\right)\%}=79g\)
a/ Số mol Fe là : nFe = 16,8: 56 = 0,3 mol
PTPƯ:
3Fe + 2O2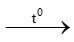 Fe3O4 (1)
Fe3O4 (1)
0,3 mol → 0,2mol → 0,1 mol
Từ (1) ta có số mol Fe3O4 = 0,1mol
→ m Fe3O4 = n.M = 0,1.232 = 23,2gam
b/ Từ (1) ta có số mol O2 đã dùng nO2 = 0,2 mol
Thể tích khí oxi đã dùng ở đktc: VO2 = n.22,4 = 0,2.22,4 = 4,48 lít
Thể tích không khí đã dùng: Vkk = 5. VO2= 5.4,48 = 22,4 lít.
c/ PTPƯ
2 KMnO4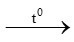 K2MnO4 + MnO2 + O2 (2)
K2MnO4 + MnO2 + O2 (2)
0,4444mol ← 0,222mol
Vì lượng Oxi thu được hao hụt 10% nên số mol O2 cần có là:
nO2 = 0,2mol.100/90 = 0.222 mol
Từ (2) ta có số mol KMnO4 = 0,444mol
Khối lượng KMnO4 bị nhiệt phân
mKMnO4 = n.M = 0,444.158 = 70.152 gam

a)
\(4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\)
Sản phẩm : Điphotpho pentaoxit.
b)
\(n_P = \dfrac{6,2}{31} = 0,2(mol)\\ \Rightarrow n_{P_2O_5} = \dfrac{1}{2}n_P = 0,1(mol)\\ \Rightarrow m_{P_2O_5} = 0,1.142 = 14,2(gam)\)
c)
\(n_{O_2} = \dfrac{5}{4}n_P = 0,125(mol)\\ \Rightarrow V_{O_2} = 0,125.22,4 = 2,8(lít)\)
d)
\(V_{không\ khí} = \dfrac{2,8}{20\%} = 14(lít)\)

\(n_{Fe}=\dfrac{1,68}{56}=0,03\left(mol\right)\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,03 0,02 0,01 ( mol )
\(m_{Fe_3O_4}=0,01.232=2,32\left(g\right)\)
\(V_{kk}=0,02.22,4.5=2,24\left(l\right)\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
\(\dfrac{1}{75}\) 0,02 ( mol )
\(m_{KClO_3}=\dfrac{1}{75}.122,5=1,63\left(g\right)\)
a,nFe=1,68/56=0,03 mol
Ta có PTHH : 3Fe + 2O2 --> Fe3O4 (1) ( ở trên dấu --> có to nha )
Theo PTHH ta có :
nFe3O4=1/3nFe=1/3.0,03=0,01 mol
nO2=2/3nFe=2/3.0,03=0,02 mol
=>mFe3O4= 0,01.232=2,32g
=>Vkk=5.(0,02.22,4)=2,24 l
b, Ta có PTHH: 2KClO3 --> 2KCl + 3O2 (2) ( trên dấu --> vẫn có to )
Gọi x là số mol KClO3 cần dùng ( x > 0 )
Theo PTHH (3) và theo bài ra ta có PTHH sau:
2/3x=0,02
=> x=0,03 mol
=> mKClO3= 0,03.122,5= 3,675g
![]()
2Zn+O2-to>2ZnO
0,1--0,05------0,1
n Zn=\(\dfrac{6,5}{65}\)=0,1 mol
=>VO2=0,05.22,4=1,12l
=>m ZnO=0,1.81=8,1g
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(2Zn+O_2\rightarrow\left(t^o\right)2ZnO\)
0,1 0,05 0,1 ( mol )
\(V_{O_2}=0,05.22,4=1,12l\)
\(m_{ZnO}=0,1.81=8,1g\)