Bài 3(2 điểm)Dẫn dòng khí H2 dư qua hỗn hợp gồm 4,46g PbO ở nhiệt độ cao
a/ Viết phương trình hóa học của các phản ứng?b/ Cho biết vai trò của H2.
c/ Tính khối lượng kim loại Pb thu được spư. d/ tính số thể tích H2 đã tham gia các pư.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vai trò của H2 là chất khử oxi
nPbO = 2,23/223 = 0,01 (mol)
nCuO = 3,2/80 = 0,04 (mol)
PTHH:
PbO + H2 -> (t°) Pb + H2O
0,01 ---> 0,01 ---> 0,01
CuO + H2 -> (t°) Cu + H2O
0,04 ---> 0,04 ---> 0,04
mPb = 0,01 . 217 = 2,17 (g)
mCu = 0,04 . 64 = 2,56 (g)
nH2 = 0,04 + 0,01 = 0,05 (mol)

Bài 11:
\(a,n_{Fe_2O_3}=\dfrac{1,6}{160}=0,01\left(mol\right)\\ n_{Cu}=\dfrac{4}{80}=0,05\left(mol\right)\\ PTHH:\\ Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,01 -----> 0,03 ---> 0,02
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,05 ---> 0,05 -> 0,05
\(b,m_{Fe}=0,02.56=1,12\left(g\right)\\ m_{Cu}=0,05.64=3,2\left(g\right)\\ V_{H_2}=\left(0,03+0,05\right).22,4=1,792\left(l\right)\)
Bài 12:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{O\left(trong.oxit\right)}=n_{H_2}=0,15\left(mol\right)\\ n_{Fe\left(trong.oxit\right)}=\dfrac{8-0,15,16}{56}=0,1\left(mol\right)\\ CTHH:Fe_xO_y\\ \Rightarrow x:y=0,1:0,15=2:3\\ CTHH:Fe_2O_3\)

\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02mol\)
\(n_{Cu}=\dfrac{8}{80}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,02 0,06 0,04 ( mol )
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,1 0,1 0,1 ( mol )
\(m_{Fe}=0,04.56=2,24g\)
\(m_{Cu}=0,1.64=6,4g\)
\(n_{H_2}=0,06+0,1=0,16mol\)
\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02mol\)
\(m_{CuO}=\dfrac{8}{80}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(CuO+H_2\rightarrow Cu+H_2O\)
\(m_{Fe}=0,02\cdot2\cdot56=2,24g\)
\(m_{Cu}=0,1\cdot64=6,4g\)
\(\Sigma n_{H_2}=0,02\cdot3+0,1=0,16mol\Rightarrow V_{H_2}=3,584l\)

Gọi x là khối lượng Fe
Khối lượng Pb là: 3,696.x
Ta có: mPb+mFe=52,6⇔x+3,696x=52,6⇒x≃11,2g
mFe≃11,2g→nFe=0,2mol
mPb=11,2.3,696≃41,4g→nPb=\(\dfrac{41,4}{207}\)=0,2mol
=>%Fe=\(\dfrac{11,2}{52.6}.100=21,29\%\)
=>%Pb=78,71%
PbO+H2→Pb+H2O
0,2 <-----0,2
Fe2O3+3H2→2Fe+3H2O
0,3 <------0,2
nH2=0,2+0,3=0,5mol→VH2=0,5.22,4=11,2l

nFe2O3 = 16,8/56 = 0,3 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
MOL: 0,15 <--- 0,45 <--- 0,3
VH2 = 0,45 . 22,4 = 10,08 (l)
mFe2O3 = 0,45 . 160 = 72 (g)
a ) Fe2O3 + 3H2 ---> 2Fe + 3H2O
nFe = 16,8 :56 =0,3
Fe2O3 + 3H2--> 2Fe +3H2O
0,15<------0,45<---- 0,3
VH2 = 0,45.22,4=10,08(l)
mFe2O3 = 0,15.160 =24(g)

a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
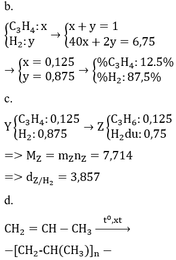


\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.1.......0.2......................0.1\)
Chất rắn X : Cu
\(m_{Zn}=0.1\cdot65=6.5\left(g\right)\Rightarrow m_{Cu}=19.3-6.5=12.8\left(g\right)\)
\(n_{Cu}=\dfrac{12.8}{64}=0.2\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
\(2Cu+O_2\underrightarrow{^{^{t^o}}}2CuO\)
\(0.2........0.1\)
\(m_{tăng}=m_{O_2}=0.1\cdot32=3.2\left(g\right)\)

a) PTHH : \(2Al+6HCl-->2AlCl_3+3H_2\) (1)
\(Fe+2HCl-->FeCl_2+H_2\) (2)
\(H_2+CuO-t^o->Cu+H_2O\) (3)
b) Ta có : \(m_{CR\left(giảm\right)}=m_{O\left(lay.di\right)}\)
=> \(m_{O\left(lay.di\right)}=32-26,88=5,12\left(g\right)\)
=> \(n_{O\left(lay.di\right)}=\frac{5,12}{16}=0,32\left(mol\right)\)
Theo pthh (3) : \(n_{H_2\left(pứ\right)}=n_{O\left(lay.di\right)}=0,32\left(mol\right)\)
=> \(tổng.n_{H_2}=\frac{0,32}{80}\cdot100=0,4\left(mol\right)\)
Đặt \(\hept{\begin{cases}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{cases}}\) => \(27a+56b=11\left(I\right)\)
Theo pthh (1) và (2) : \(n_{H_2\left(1\right)}=\frac{3}{2}n_{Al}=\frac{3}{2}a\left(mol\right)\)
\(n_{H_2\left(2\right)}=n_{Fe}=b\left(mol\right)\)
=> \(\frac{3}{2}a+b=0,4\left(II\right)\)
Từ (I) và (II) => \(\hept{\begin{cases}a=0,2\\b=0,1\end{cases}}\)
=> \(\hept{\begin{cases}m_{Al}=27\cdot0,2=5,4\left(g\right)\\m_{Fe}=56\cdot0,1=5,6\left(g\right)\end{cases}}\)
nPbO = 4,46 : 217 = 0,02 (mol)
pthh : PbO + H2 -t--> H2O + Pb
0,02 0,02 0,02
H2 dùng để khử O2
mPb = 0,02 . 201 = 4,02 (g)
VH2 = 0,02 . 22,4 = 0,448 ( L)
nPbO = 4,46 : 217 = 0,02 (mol)
pthh : PbO + H2 -t--> H2O + Pb
0,02 0,02 0,02
H2 dùng để khử PbO
mPb = 0,02 . 201 = 4,02 (g)
VH2 = 0,02 . 22,4 = 0,448 ( L)