Đun nóng 92 gam một loại quặng đolomit người ta thu được 4,928 lít CO2 (27,3oC và 2 atm). Hàm lượng CaCO3.MgCO3 trong quặng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : D
CaCO3.MgCO3 à 2CO2
0,25 ß 0,5 mol
=>m= 0 , 25 . ( 100 + 84 ) . 100 80 = 57 , 5 g

\(n_{CO_2} = 0,1(mol)\)
CaCO3.MgCO3 + 4HCl → CaCl2 + MgCl2 + 2CO2 + 2H2O(1)
........0,05...............0,2.......................0,05.......0,1..........................(mol)
\(n_{NaOH}= 0,12(mol)\)
MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl(2)
..0,1...........0,2.................................................(mol)
HCl + NaOH → NaCl + H2O(3)
0,02.....0,02................................(mol)
Theo PTHH (1)(3) suy ra :
\(n_{HCl} = 0,2 + 0,02 = 0,22(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,22}{1} = 0,22(lít)\)

Quặng đôlomit có thành phần MgCO3 .CaCO3
CaCO3.MgCO3 \(\rightarrow\) CaO + MgO + 2CO2 ↑
0,2_________________________0,4
Thành phần phần trăm về khối lượng của CaCO .MgCO trong loại quặng là :
%CaCO3.MgCO3 =\(\frac{0,2.\left(100+84\right)}{40}.100\%=92\%\)
MgCO3.CACO3=>CO2
nCo2=0.4=>nCACO3.MgCO3=0.2=>m=36.8g=>%=36.8*100/40=92%
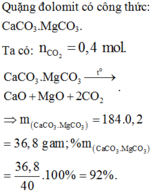



\(n_{CO_2}=\dfrac{PV}{RT}=\dfrac{4.928\cdot2}{0.082\cdot\left(273+27.3\right)}=0.4\left(mol\right)\)
\(\)\(CaCO_3\cdot MgCO_3\underrightarrow{^{t^0}}MgO+CaO+CO_2\)
\(0.4.................................................0.4\)
\(m=0.4\cdot\left(100+84\right)=73.6\left(g\right)\)
\(\%CaCO_3\cdot MgCO_3=\dfrac{73.6}{92}\cdot100\%=80\%\)
ko có đáp án 80% bn xém lại giùm mình`