Cho 11,2 lít hỗn hợp khí mêtan và axetilen đi qua 50 ml dung dịch brôm 2M đến khi phản ứng xảy ra hoàn toàn. Tìm tỉ lệ % theo thể tích mỗi khí trong hỗn hợp ban đầu. Các chất khí đo ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%

\(n_{hh}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{Br_2}=\dfrac{2,4}{160}=0,015mol\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
0,0075 0,015 ( mol )
\(V_{C_2H_2}=0,0075.22,4=0,168l\)
\(V_{CH_4}=3,36-0,168=3,192l\)
\(\%V_{C_2H_2}=\dfrac{0,168}{3,36}.100=5\%\)
\(\%V_{CH_4}=100\%-5\%=95\%\)

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

a, \(n_{Br_2}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
_____0,15____0,3 (mol)
\(\Rightarrow\%V_{C_2H_2}=\dfrac{0,15.22,4}{11,2}.100\%=30\%\)
\(\Rightarrow\%V_{CH_4}=100-30=70\%\)
b, - Khí thoát ra ngoài là CH4.
\(V_{CH_4}=11,2.70\%=7,84\left(l\right)\)

a. Phương trình phản ứng :
C2H2 + 2Br2 → C2H2Br4 (1)
C2H4 + Br2 → C2H4Br2 (2)
b. Hỗn hợp khí B gồm có H2, C2H6. Gọi x, y ( mol ) lần lượt là số mol của H2 và C2H6 có trong 6,72 lít hỗn hợp B.
nB = x + y = 6,72 : 22,4 = 0,3 mol (I)
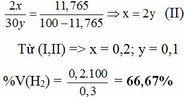
% V(C2H6) = 100% – 66,67% = 33,33%
c. nA = 11,2 : 22,4 = 0,5 mol , M A = 0,4 . 44 = 17,6 g/ mol
mA = 0,5 . 17,6 = 8,8 gam
mB = 0,2 . 2 + 0,1 . 30 = 3,4 gam
Vậy khối lượng bình Br2 tăng: m = mA – mB = 8,8 – 3,4 = 5,4 gam.


\(n_{Br_2}=0,05.2=0,1\left(mol\right)\)
PTHH: C2H2 + 2Br2 ---> C2H2Br4
0,05 0,1
\(n_{hhkhí}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}\%V_{C_2H_2}=\dfrac{0,05}{0,5}=10\%\\\%V_{CH_4}=100\%-10\%=90\%\end{matrix}\right.\)