Có V lít hỗn hợp khí gồm CO và H2. Chia hh thành 2 phần bằng nhau
- Đốt cháy hoàn toàn phần thứ nhất bằng oxi. Sau đó dẫn sản phẩm qua nước vôi trong (dư) thu được 20g kết tủa trắng
- Dẫn phần thứ 2 đi qua bột đồng oxit nóng dư. Phản ứng xong thu được 19,2g khối lượng đồng
a, Viết PTPƯ xảy ra
b, tính thể tích của V lít hh khí ban đầu(đktc)
c, tính thành phần % của hỗn hợp khí ban đầu theo khối lượng và thể tích
( mọi người giải nhanh hộ mình, mình đang cần gấp)


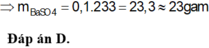
Phần 1:
2CO + O2 -to> 2CO2
2H2 + O2 -to> 2H2O
Dẫn sản phẩm qua nước vôi trong
CO2 + Ca(OH)2 -> CaCO3 + H2O
-> mCaCO3=20 gam -> nCaCO3=nCO2=0,2 mol=nCO
PHần 2:
CuO + CO -to> Cu + CO2
CuO + H2 -to> Cu + H2O
Ta có: nCu=19,2/64=0,3 mol=nCO +nH2
Mà nCO=0,2 mol -> nH2=0,1 mol
-> hỗn hợp ban đầu chứa 0,4 mol CO và 0,2 mol H2
-> n hỗn hợp=0,4+0,2=0,6 mol -> V hỗn hợp=0,6.22,4=13,44 lít
Ta có: % thể tích= % số mol
->% V CO=\(\dfrac{0,4}{0,6}\)=66,67% ->% V H2=33,33%
m hỗn hợp=0,4.28+0,2.2=11,6 gam
-> % mCO=\(\dfrac{0,4.28}{11,6}\)=96,55% ->%mH2=3,45%