Bài 10. Cho 10,8 gam hỗn hợp gồm Mg và Al vào dung dịch axit clohiđric (HCl) dư. Tính thể tích khí H2 sinh ra ở đktc. Biết rằng các phản ứng xảy ra hoàn toàn.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a.Ta có n HCl = 1 . 0,25 = 0,25 mol
nH2SO4 = 0,5.0.25 = 0,125 mol
==> nH(X) = 0,25 + 0,125.2 = 0,5 mol
nH2 = 4,368/22,4 = 0,195 mol <=> nH= 0,195. 2 = 0,39 mol < 0,5 mol
Vậy sau phản ứng dung dịch B vẫn còn axit dư
b. Gọi số mol của Al và Mg lần lượt là x và y mol
Ta có phương trình 27x + 24y =3,87 (1)
Áp dụng định luật bảo toàn eletron ==> 3x + 2y = 0,195.2 (2)
Từ (1) , (2) ==> \(\left\{{}\begin{matrix}x=0,09\\y=0,06\end{matrix}\right.\)
mAl = 0,09 .27 = 2,43 gam , %mAl trong A = \(\dfrac{2,43}{3,87}\).100=62,8%
==> %mMg trong A = 100 - 62,8 = 37,2%

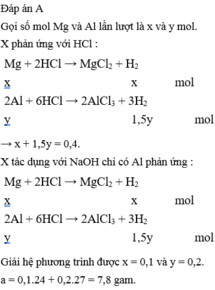
Đáp án A
Gọi số mol Mg và Al lần lượt là x và y mol.
X phản ứng với HCl :
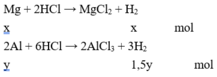
→ x + 1,5y = 0,4.
X tác dụng với NaOH chỉ có Al phản ứng :
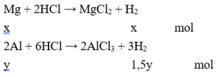
Giải hệ phương trình được x = 0,1 và y = 0,2.
a = 0,1.24 + 0,2.27 = 7,8 gam.

Có n H 2 = n F e = 0 , 15 m o l
⇒ V H 2 = 3 , 361
=> Chọn đáp án B

`Mg + 2HCl -> MgCl_2 + H_2`
`0,15` `0,3` `0,15` `(mol)`
`n_[Mg]=[3,6]/24=0,15(mol)`
`a)V_[H_2]=0,15.22,4=3,36(l)`
`b)m_[HCl]=0,3.36,5=10,95(g)`
`c)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,15` `0,15` `(mol)`
`=>m_[Cu]=0,15.64=9,6(g)`
\(n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right)\)
PTHH: Mg + 2HCl ---> MgCl2 + H2
0,15->0,3------------------>0,15
CuO + H2 --to--> Cu + H2O
0,15------>0,15
=> \(V_{H_2}=0,15.22,4=3,36\left(l\right)\\ m_{HCl}=0,3.36,5=10,95\left(g\right)\\ m_{Cu}=0,15.64=9,6\left(g\right)\)
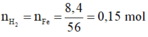





thiếu đề ạ ?