Cho 6,72 lít khí clo (đktc) tác dụng với 8,1 gam Al thu được m gam hỗn hợp chất rắn X. Cho toàn bộ hỗn hợp X vào dung dịch AgNO3 (dư) thu được m1 gam kết tủa. Giá trị của m và m1 lần lượt là
29, 4 và 118,5
118, 5 và 29,4
32,2 và 212,3
212,3 và 32,2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Kết thúc phản ứng còn dư lại m1 (g) chất rắn Z
=> Z là Cu, dd Y gồm FeCl2 và CuCl2.
Fe3O4 + 8HCl → 2FeCl3 + FeCl2
0,01<---- 0,08 ------> 0,01
=> n C u = 0,02
2FeCl3 + Cu → 2FeCl2 + CuCl2
0,02 -----> 0,01 --> 0,02
=> n C u dư = 0,01 => m1 = 6,4g
dd Y tác dụng với A g N O 3
Ag+ + Cl- → AgCl
0,08 <--- 0,08 ----> 0,08
Fe2+ + Ag+ → Fe3+ + Ag
0,03 → 0,03
=> m2 = 0,03.108 + 0,08.143,5 = 14,72g

Chọn đáp án D
Vì thu được H2 khi cho X phản ứng với KOH Þ Có Al dư Þ Toàn bộ oxit Fe đã bị khử về Fe
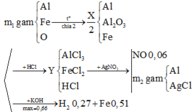
Xét phần 2: Bảo toàn nguyên tố: nKOH = nKAlO2 = nAl + 2nAl2O3 = 0,66
nAl dư trong 0,5X = 0,27/1,5 = 0,18 Þ nAl phản ứng = 2nAl2O3 = 0,66 - 0,18 = 0,48
Rắn không tan chính là Fe Þ nFe = 28,56/56 = 0,51 Þ m1/2 = 28,56 + 0,24x102 + 0,18x27 = 57,9.
Xét phần 1: nH+ trong Y = 0,06x4 = 0,24
BTĐT Þ nCl- = 0,66x3 + 0,51x2 + 0,24 = 3,24 = nAgCl
BTE Þ nAg = 0,51 - 0,06x3 = 0,33 Þ m2 = 0,33x108 + 3,24x143.5 = 500,58
Vậy m1 + m2 = 57,9x2 + 500,58 = 616,38.
C
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\); \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
PTHH: 2Al + 3Cl2 -to-> 2AlCl3
Xét tỉ lệ: \(\dfrac{0,3}{2}>\dfrac{0,3}{3}\) => Cl2 hết
Theo ĐLBTKL: m = 8,1 + 0,3.71 = 29,4 (g)
PTHH: 2Al + 3Cl2 -to-> 2AlCl3
0,2<--0,3------->0,2
AlCl3 + 3AgNO3 --> Al(NO3)3 + 3AgCl
0,2-------------------------------->0,6
Al + 3AgNO3 --> Al(NO3)3 + 3Ag
0,1--------------------------->0,3
=> m1 = 0,6.143,5 + 0,3.108 = 118,5 (g)
=> A