tính thành phần phần trăm khối lượng C hợp chất CH4,C2H4,C2H2,C2H3OH và xác định nguyên tử C trong hợp chất nào lớn nhất
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1
\(MP_2O_3=110g/mol\)
\(\%P=\dfrac{31.2.100}{110}=58,2\%\)
\(\%O=100-58,2=41,8\%\)
2
\(MA=8.2=16g/mol\)
Tính theo hoá trị
=> cthh của A là CH\(_4\)

Coi \(m_{CH_4} = m_{C_2H_4} = 224(gam)\\ \Rightarrow n_{CH_4} = \dfrac{224}{16} = 14(mol)\\ \Rightarrow n_{C_2H_4} = \dfrac{224}{28} = 8(mol)\)
Vậy :
\(\%n_{CH_4} = \dfrac{14}{14+8}.100\% = 63,64\%\\ \%n_{C_2H_4} = 100\% - 63,64\% = 36,36\%\)
\(GS:\)
\(n_{hh}=1\left(mol\right)\)
\(n_{CH_4}=a\left(mol\right),n_{C_2H_4}=b\left(mol\right)\)
\(\Rightarrow a+b=1\left(1\right)\)
\(TC:\)
\(16a=28b\left(2\right)\)
\(\left(1\right),\left(2\right):a=\dfrac{7}{11},b=\dfrac{4}{11}\)
\(\%n_{CH_4}=\dfrac{7}{11}\cdot100\%=63.64\%\)
\(\%n_{C_2H_4}=36.36\%\)
Em xem thử cách làm này nhé !!

\(n_{CH_4}=\dfrac{2}{16}=0,125\left(mol\right)\)
\(PTHH:CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(\left(mol\right)\) \(0,125\) \(0,25\)
Đặt \(\left\{{}\begin{matrix}n_{KMnO_4}=a\left(mol\right)\\n_{KClO_3}=b\left(mol\right)\end{matrix}\right.\)
\(\%m_K=26,68\left(\%\right)\Leftrightarrow\dfrac{39\left(a+b\right)}{158a+122,5b}=\dfrac{26,68}{100}\)
Lại có: \(0,5a+1,5b=0,25\) ( Cái này viết PTHH ra mới thấy)
\(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{KMnO_4}=72\left(\%\right)\\\%m_{KClO_3}=28\left(\%\right)\end{matrix}\right.\)
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
$n_{O_2} = 2n_{CH_4} = 2.\dfrac{2}{16} = 0,25(mol)$
Gọi $n_{KMnO_4} = a(mol) ; n_{KClO_3} = b(mol)$
Ta có :
$\dfrac{39(a + b)}{158a + 122,5b} = \dfrac{26,68}{100}(1)$
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$n_{O_2} = 0,5a + 1,5b = 0,25(2)$
Từ (1)(2) suy ra a = 0,19 ; b = 0,1$
Ta có :
$\%m_{KMnO_4} = \dfrac{0,19.158}{0,19.158 + 0,1.122,5}.100\% = 71\%$
$\%m_{KClO_3} = 100\% - 71\% = 29\%$

Khối lượng mol :
MKMnO4 = 39 + 55 + 64 = 158 (g/mol)
Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất :
nK = 1 mol
nMn = 1 mol
nO = 4 mol
Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất :
mK = 39.1 = 39 (g)
mMn = 55.1 = 55 (g)
mO = 16.4 = 64 (g)
Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất :
\(\%m_K=\frac{m_K}{M_{KMnO_4}}.100\%=\frac{39}{158}.100\%=24,7\%\)
\(\%m_{Mn}=\frac{m_{Mn}}{M_{KMnO_4}}.100\%=\frac{55}{158}.100\%=34,8\%\)
\(\%m_O=\frac{m_O}{m_{KMnO_4}}.100\%=\frac{64}{158}.100\%=40,5\%\)
Các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
B1 : Tính khối lượng mol (M) của hợp chất.
B2 : Tính số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Tính khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B4 : Tính thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.

a)Gọi hợp chất cần tìm là \(X_2O_3\)
Theo bài ta có: \(PTK_{X_2O_3}=76M_{H_2}=76\cdot2=152\left(đvC\right)\)
b)Mà \(2M_X+3M_O=152\Rightarrow M_X=\dfrac{152-3\cdot16}{2}=52\left(đvC\right)\)
X là nguyên tố Crom(Cr).
Vậy CTHH là \(Cr_2O_3\).
c)\(\%X=\dfrac{2\cdot52}{2\cdot52+3\cdot16}\cdot100\%=68,42\%\)

a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Ta có: \(n_{C_2H_4}+n_{C_2H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(1\right)\)
Theo PT: \(n_{Br_2}=n_{C_2H_4}+2n_{C_2H_2}=0,25.2=0,5\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{C_2H_4}=0,3\left(mol\right)\\n_{C_2H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,3.22,4}{8,96}.100\%=75\%\\\%V_{C_2H_2}=25\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{C_2H_4Br_2}=n_{C_2H_4}=0,3\left(mol\right)\\n_{C_2H_2Br_4}=n_{C_2H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{C_2H_4Br_2}=0,3.188=56,4\left(g\right)\\m_{C_2H_2Br_4}=0,1.346=34,6\left(g\right)\end{matrix}\right.\)

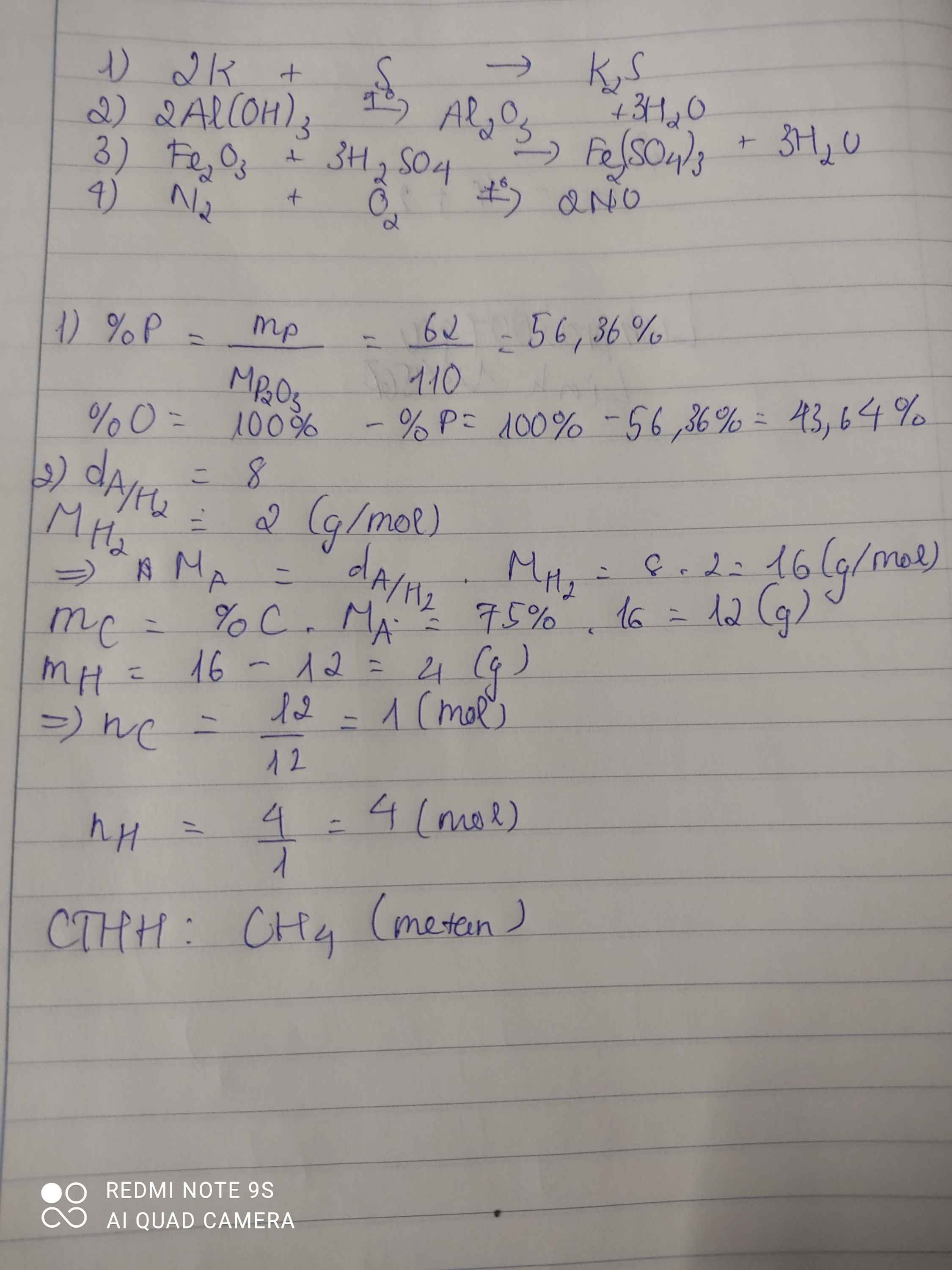
\(\%m_{C\left(CH_4\right)}=\frac{12}{12+4}.100\%=75\%\)
\(\%m_{C\left(C_2H_4\right)}=\frac{12.2}{12.2+4}.100\%\approx85,71\%\)
\(\%m_{C\left(C_2H_2\right)}=\frac{12.2}{12.2+2}.100\%\approx92,31\%\)
\(\%m_{C\left(C_2H_3OH\right)}=\frac{12.2}{12.2+4+16}.100\%\approx54,55\%\)
Vậy \(C_2H_2\) có %C lớn nhất.