Cho 2,16g kim loại A(III) tan vào dung dịch chứa 11,76g Axit Sunfuric thì vừa đủ. Sau PƯ xảy ra xong thì: a) Điều chế được mấy lít H2(ĐKTC)? Thu được mấy bình khí H2 dung tích 50ml , biết khi thu H2 bị hao hụt 30%. b) A là kim loại gì? c) Dung dịch sau PƯ chứa chất gì? Mấy gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)nAl=2,16/27=0,08(mol)
mH2SO4=250.19,6/100=49(g)
nH2SO4=49/98=0,5(mol)
2Al+3H2SO4--->Al2(SO4)3+3H2
lập tỉ số: nAl=0,08/2=0,04
nH2SO4=0,5/3=0,167
vì 0,04<0,167=>H2SO4 dư và Al hết
theo PTHH: nH2=1,5nAl=1,5.0,08=0,12(mol)
VH2(đktc)=22,4.012=2,688(l)
thể tích H2 còn lại là:
VH2(còn lại)=2,688-2,688.30/100=1,8816(l)
số bình khí H2 50 ml cần dùng là:
1,8816/0,05=37,632
vì bình luôn luôn phải là số nguyên
=>cần 38 bình
b)dung dịch sau phản ứng gồm Al2(SO4)3 và H2SO4 dư
theo PTHH: nH2SO4=1,5nAl=1,5.0,08=0,12(mol)
nAl2(SO4)3=0,5nAl=0,5.0,08=0,04(mol)
nH2SO4(dư)=0,5-0,12=0,38(mol)
mAl2(SO4)3=0,04.342=13,68(g)
mH2SO4=98.0,38=37,24(g)

nZn = 19,5/65 = 0,3 (mol)
nH2SO4 = 49/98 = 0,5 (mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
LTL: 0,3 < 0,5 => H2SO4 dư
nH2SO4 (phản ứng) = mZnSO4 = 0,3 (mol)
mH2SO4 (dư) = (0,5 - 0,3) . 98 = 19,6 (g)
mZnSO4 = 0,3 . 161 = 48,3 (g)
PTHH: CuO + H2 -> (t°) Cu + H2O
Mol: 0,3 <--- 0,3 ---> 0,3
mCu = 0,3 . 64 = 19,2 (g)

Đặt :
nAl = a (mol)
nFe = b(mol)
mX = 27a + 56b = 16.6 (g) (1)
2Al + 3H2SO4 => Al2(SO4)3 + 3H2
Fe + H2SO4 => FeSO4 + H2
mM = 342a + 152b = 64.6 (g) (2)
(1) , (2):
a = 4/55
b = 23/88
%Al = (4/55*27) / 16.6 *100% = 11.83%
%Fe = 100 - 11.83 = 88.17%
nH2 = 3/2a + b = 3/2 * 4/55 + 23/88 = 163/440 (mol)
VH2 = 8.3 (l)

Gọi KL là R
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6(mol)\\ a,2R+6HCl\to 2RCl_3+3H_2\\ \Rightarrow n_R=0,4(mol)\\ \Rightarrow M_R=\dfrac{10,8}{0,4}=27(g/mol)(Al)\\ b,n_{HCl}=1,2(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,2.36,5}{14,6\%}=300(g)\)

nH2= 3,36/22,4=0,15 mol
TH1 R có hóa trị 1
2R + 2HCl --> 2RCl + H2
0,3 0,15 mol
M R = 2,7/0,3= 9 => Be (ktm vì Be hóa trị 2)
TH2 R có hóa trị 2
R + 2HCl --> RCl2 + H2
0,15 0,15 mol
M R =2,7/0,15=Ar (ktm vì Ar là khí hiếm )
TH3 R có hóa trị 3
2R + 6HCl --> 2RCl3 + 3H2
0,1 0,15 mol
M R =2,7/0,1=27 (thỏa mãn ) => R là Al
pthh 2Al + 6HCl --> 2AlCl3 + 3H2 (1)
0,1 0,3 mol
=> V HCl = 0,3*22,4=6,72 l
nAl = 4,05/27=0,15 mol : n H2=4,48/22,4=0,2 mol
pthh 2Al + 6HCl --> 2AlCl3 + 3H2 (2)
2/15 0,2 mol
ta thấy nAl/2 > nH2/3 => Al dư , H2 hết
(2)=> mAl = 2/15*27=3,6 g
=> phản ứng (2) HCl hết , phản ứng (1) HCl dư

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
=> nHCl = 0,8 (mol)
Theo ĐLBTKL: mA,B + mHCl = mmuối + mH2
=> mA,B = 39,4 + 0,4.2 - 0,8.36,5 = 11 (g)

a) \(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
=> nHCl = 0,27 (mol)
Theo ĐLBTKL: mkim loại + mHCl = mmuối + mH2
=> mmuối = 5,85 + 0,27.36,5 - 0,135.2 = 15,435 (g)
b) VH2 = 3,024 (l) (Theo đề bài)
c)
Hỗn hợp kim loại gồm \(\left\{{}\begin{matrix}Al:a\left(mol\right)\\X:3a\left(mol\right)\end{matrix}\right.\)
=> 27a + MX.3a = 5,85
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
X + 2HCl --> XCl2 + H2
3a------------------->3a
=> 1,5a + 3a = 0,135
=> a = 0,03 (mol)
=> MX = 56 (g/mol)
=> X là Fe

a) \(Na_2O+H_2O\rightarrow2NaOH\)
\(n_{NaOH}=2n_{Na_2O}=2.\dfrac{11,16}{62}=0,32\left(mol\right)\)
\(C\%_{NaOH}=\dfrac{0,32.40}{11,16+88,84}.100=12,8\%\)
b) \(n_{Fe}=\dfrac{4,48}{56}=0,08\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=n_{Fe}=0,08\left(mol\right)\\ \Rightarrow V_{H_2}=0,08.22,4=1,792\left(lít\right)\)
\(n_{HCl}=2n_{Fe}=0,16\left(mol\right)\)
\(m_{ddHCl}=\dfrac{0,16.36,5}{7,3\%}=80\left(g\right)\)
\(n_{FeCl_2}=n_{Fe}=0,08\left(mol\right)\\ m_{ddsaupu}=4,48+80-0,08.2=84,32\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{0,08.127}{84,32}.100=12,05\%\)
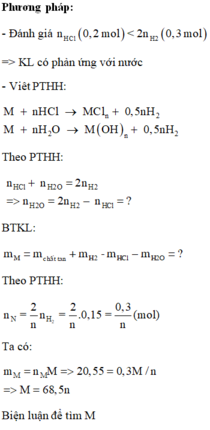


a) \(n_{H_2SO_4}=\dfrac{11,76}{98}=0,12\left(mol\right)\)
PTHH: 2A + 3H2SO4 --> A2(SO4)3 + 3H2
0,08<--0,12------->0,04------>0,12
=> VH2(sinh ra) = 0,12.22,4 = 2,688 (l)
\(V_{H_2\left(thu.được\right)}=\dfrac{2,688.70}{100}=1,8816\left(l\right)\)
=> Số bình = \(\dfrac{1,8816.10^3}{50}\approx38\left(bình\right)\)
b) \(M_A=\dfrac{2,16}{0,08}=27\left(g/mol\right)\)
=> A là Al
c) dd sau pư chứa Al2(SO4)3
mAl2(SO4)3 = 0,04.342= 13,68 (g)