Hỗn hợp X gồm Fe(NO3)2;Cu(NO3)2;AgNO3 Trong X nguyên tố Nitơ chiếm 11,864% về khối lượng. Từ 17,7 gam X có thể điều chế tối đa được m gam hỗn hợp 3 kim loại Fe, Cu, Ag. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Trong 14,16 gam X chứa mN = 14,16 × 0,11864 = 1,68 gam Û nN = 0,12 mol.
Nhận thấy Hỗn hợp X chứa kim loại và gốc nitrat (NO3–).
Từ NO3 ⇒ tỉ lệ nN:nO = 1:3 ⇒ nO = 0,12×3 = 0,36 mol.
Bảo toàn khối lượng hỗn hợp X ⇒ mKim loại = 14,16 – 1,68 – 0,36×16 = 6,72 gam.
⇒ Có thể điều chế tối 6,72 gam hỗn hợp ba kim loại từ 14,16 gam X

Trong 14,16 gam X chứa mN = 14,16 × 0,11864 = 1,68 gam
nN = 0,12 mol.
Nhận thấy Hỗn hợp X chứa kim loại và gốc nitrat (NO3–).
Từ NO3 ⇒ tỉ lệ nN:nO = 1:3
⇒ nO = 0,12×3 = 0,36 mol.
Bảo toàn khối lượng hỗn hợp X
⇒ mKim loại = 14,16 – 1,68 – 0,36×16 = 6,72 gam.
⇒ Có thể điều chế tối 6,72 gam hỗn hợp ba kim loại từ 14,16 gam X
Đáp án B

Đáp án B
Coi hỗn hợp X gồm hỗn hợp kim loại M và gốc NO3
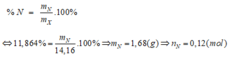
=> nNO3 = nN = 0,12 (mol)
=> m hh M = mX – mNO3 = 14,16 – 0,12. 62 = 6,72 (g)

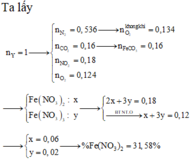
Số mol của các muối trong X lần lượt là x ; 4y ; y . Các phản ứng nhiệt phân :
2Fe(NO3)2 → Fe2O3 + 4NO2 + ½ O2
Ca(NO3)2 → Ca(NO2)2 + O2
AgNO3 → Ag + NO2 + ½ O2
n O2 = (0,25x + 3y) mol ; n NO2 = (2x + 4y) mol
Khi cho khí vào nước dư không có khí thoát ra => NO2 phản ứng vừa đủ với O2
2NO2 + ½ O2 + H2O → 2HNO3
4(0,25x + 3y) = 2x + 4y => x = 8y
=>%m Fe(NO3)2 = 63,05%
=>D

Đáp án D
Phương pháp: Dựa vào dãy điện hóa (quy tắc α)
Hướng dẫn giải:
Kim loại thu được là Ag. Do thu được 1 KL nên Fe, Mg hết.
Thứ tự các kim loại phản ứng với AgNO 3 : Mg, Fe
TH1:
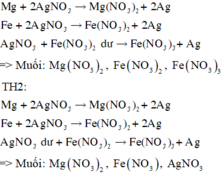


\(n_{NO_3} =n_N= \dfrac{17,7.11,864\%}{14} = 0,15(mol)\\ m_{kim\ loại} = m_{muối} - m_{NO_3} = 17,7 - 0,15.62 = 8,4(gam)\)