Cho 2,8 (1) hỗn hợp khí A gồm CH4 và C2H4 (ở đktc) đi qua dung dịch brom khối lượng dung dịch này giảm 8 gam.
a. Viết phương trình hoá học phản ứng
b. Tính % thế tích mỗi khí trong hỗn hợp A.
c. Nếu đốt cháy toàn bộ hỗn hợp khí A trên thì cần dùng bao nhiêu lít ko khí chứa 20% thể tích khí oxi?
( Biết các khí đo ở đktc)
Giúp e vs ạ

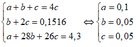
a, nBr2 = 8/160 = 0,05 (mol)
PTHH: C2H4 + Br2 -> C2H4Br2
Mol: 0,05 <--- 0,05 <--- 0,05
Vhh khí = 2,8/22,4 = 0,125 (mol)
%VC2H4 = 0,05/0,125 = 40%
%CH4 = 100% - 40% = 60%
b, nCH4 = 0,125 - 0,05 = 0,075 (mol)
PTHH: C2H4 + 3O2 -> (t°) 2CO2 + 2H2O
Mol: 0,05 ---> 0,15
CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,075 ---> 0,15
Vkk = (0,15 + 0,15) . 5 . 22,4 = 33,6 (l)