Chờ mẩu Na vào nước thấy có 4, 48 lít khí bay lên . Tính khối lượng Na
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Na + 2H2O \(\rightarrow\) 2NaOH + H2
\(nH_2=\dfrac{4,48}{22,4}=0,2mol\)
Theo pt: nNa = 2nH2 = 0,4 mol
=> mNa = 0,4 . 23 = 9,2g
PT:\(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có:\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT:\(n_{Na}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{Na}=0,4.23=9,2\left(g\right)\)

nH2 = 2.24/22.4 = 0.1 (mol)
2Na + 2H2O => 2NaOH + H2
0.2.........................................0.1
mNa = 0.2 * 23 = 4.6 (g)
n\(_{H_2}\)= \(\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
2 Na + 2 H\(_2O\) → 2 NaOH + H\(_2\)
0,2 mol ← 0,1 mol
m\(_{Na}=m.n=0,2.23=4,6\left(g\right)\)
Vậy mẫu Na có khối lượng 4,6 g

2Na + 2H2O ---> H2 + 2NaOH
nH2 = 4,48/22,4 = 0,2mol
=>nNa = 0,4mol
=>mNa = 0,4.23 =9,2gam

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Theo PT: \(n_{Na}=2n_{H_2}=0,4\left(mol\right)\Rightarrow m_{Na}=0,4.23=9,2\left(g\right)\)
b, \(n_{NaOH}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow C_{M_{NaOH}}=\dfrac{0,4}{2}=0,2\left(M\right)\)

PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\) (1)
\(Na_2O+H_2O\rightarrow2NaOH\) (2)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\) (3)
Ta có: \(\left\{{}\begin{matrix}n_{Na}=2n_{H_2\left(1\right)}=2\cdot\dfrac{2,24}{22,4}=0,2\left(mol\right)\\n_{Fe}=n_{H_2\left(3\right)}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Na}=\dfrac{0,2\cdot23}{16,4}\cdot100\%\approx28,05\%\\\%m_{Fe}=\dfrac{0,05\cdot56}{16,4}\cdot100\%\approx17,07\%\\\%m_{Na_2O}=54,88\%\end{matrix}\right.\)

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư
⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2)
⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam
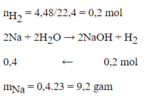
PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Na}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{Na}=0,4.23=9,2\left(g\right)\)
Bạn tham khảo nhé!