Điện phân nóng chảy a gam muối A tạo bởi kim loại M và halogen X ta thu được 0,96g kim loại M ở catốt và 0,896 lít khí (đktc) ở anốt. Mặt khác hoà tan a gam muối A vào nước, sau đó cho tác dụng với AgNO3 dư thì thu được 11,48 gam kết tủa.
1. Hỏi X là halogen nào ?
2. Trộn 0,96 gam kim loại M với 2,242 gam kim loại M’ có cùng hoá trị duy nhất, rồi đốt hết hỗn hợp bằng oxi thì thu được 4,162 gam hỗn hợp hai oxit. Để hoà tan hoàn toàn hỗn hợp oxit này cần 500ml dung dịch H2SO4 nồng độ C (mol/l).
a. Tính % số mol của các oxit trong hỗn hợp của chúng.
b. Tính tỷ lệ khối lượng nguyên tử của M và M’.
c. Tính C (nồng độ dung dịch H2SO4).
Cho: F = 19; Cl = 35,5 ; Br = 80 ; I = 127 ; Ag = 108 ; O = 16.

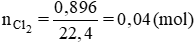
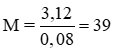 → M là K
→ M là K
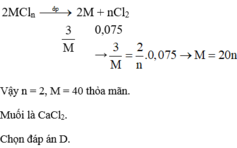
1)
CTHH MXn
\(n_{X_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
=> \(n_{MX_n}=\dfrac{0,08}{n}\left(mol\right)\)
=> \(n_{AgX}=0,08\left(mol\right)\)
=> \(M_{AgX}=\dfrac{11,48}{0,08}=143,5\left(g/mol\right)\) => MX = 35,5 (g/mol)
=> X là Cl
2)
\(n_{MCl_n}=\dfrac{0,08}{n}\left(mol\right)\)
\(n_M=\dfrac{0,96}{M_M}\left(mol\right)\)
=> \(\dfrac{0,08}{n}=\dfrac{0,96}{M_M}\)
=> MM = 12n (g/mol)
Xét n = 1 => Loại
Xét n = 2 => MM = 24 (g/mol) => M là Mg
Xét n = 3 => Loại
Vậy M là Mg
M' có hóa trị II
\(n_{O_2}=\dfrac{4,162-0,96-2,242}{32}=0,03\left(mol\right)\)
PTHH: 2Mg + O2 --to--> 2MgO
0,04-->0,02------>0,04
2M' + O2 --to--> 2M'O
0,02<-0,01------>0,02
=> MM' = \(\dfrac{2,242}{0,02}=112\left(g/mol\right)\)
a) \(\left\{{}\begin{matrix}\%n_M=\dfrac{0,04}{0,04+0,02}.100\%=66,67\%\\\%n_{M^{\cdot}}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
b) \(\dfrac{M_M}{M_{M^{\cdot}}}=\dfrac{24}{112}=\dfrac{3}{14}\)
c) \(n_O=0,06\left(mol\right)\)
=> \(n_{H_2O}=0,06\left(mol\right)\)
=> \(n_{H_2SO_4}=0,06\left(mol\right)\)
=> \(C_{M\left(H_2SO_4\right)}=\dfrac{0,06}{0,5}=0,12M\)
lm giúp mình đg cần gấp