Hòa tan 13,5 gam Al trong m gam dung dịch HCl 14,6%, đến khi phản ứng xảy ra hoàn toàn thu được 672 ml khí ở đktc. Tính C% của dung dịch thu được. 
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

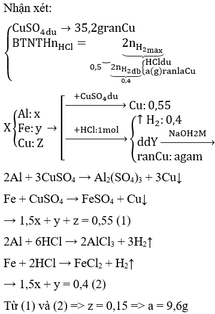
Chọn đáp án A
Dung dịch X có nAlCl3 = 0,02 và nHCl = 0,07 - 0,02x3 = 0,01
n A l O 2 - = 0,075 - 0,01 - 0,02x3 = 0,005 Þ nAl(OH)3 = 0,02 - 0,005 = 0,015
Þ m = 0,015x78 = 1,17

Đáp án D
nAl = 0,02 mol; nCl– = 0,07 mol; nNa+ = 0,075 mol.
Ghép NaCl
⇒ còn dư (0,075 – 0,07 = 0,005) mol Na+
⇒ ghép với AlO2– tạo NaAlO2.
||⇒ ghép được 0,005 mol NaAlO2 và còn dư (0,02 – 0,005 = 0,015) mol nguyên tố Al.
► Dùng nguyên tố đó ghép vào ↓ ⇒ nAl(OH)3 = 0,015 mol
⇒ m = 1,17(g)

Giải thích:
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3: m = (0,02-0,005).78 = 1,17 gam
Đáp án B

Đáp án B
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3:
m = (0,02-0,005).78 = 1,17 gam

Chọn B
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3: m = (0,02-0,005).78 = 1,17 gam

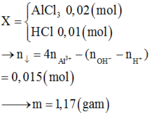
\(n_{H_2} = \dfrac{672}{1000.22,4} = 0,03(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{Al\ pư} = \dfrac{2}{3}n_{H_2} = 0,02(mol)\\ n_{HCl} = 2n_{H_2} = 0,06(mol)\\ m_{dd\ HCl} = \dfrac{0,06.36,5}{14,6\%} = 15(gam)\\ m_{dd\ sau\ pư} =m_{Al\ pư} + m_{dd\ HCl} - m_{H_2} = 0,02.27 + 15 -0,03.2 = 15,48(gam)\\ n_{AlCl_3} = n_{Al\ pư} = 0,02(mol)\\ \Rightarrow C\%_{AlCl_3} = \dfrac{0,02.133,5}{15,48} .100\% =17,25\%\)